2020年1月,我国科学家鉴定出一种新型冠状病毒,即2019新型冠状病毒(2019-nCoV),由此揭示了这种引起国内外广泛关注的传染性病毒性肺炎的元凶[1]。随后,世界卫生组织(WHO)将这种新型冠状病毒正式命名为SARS-CoV-2,由其引发的疾病称为2019冠状病毒病(corona virus disease 2019,COVID-19)。同时,另外两种冠状病毒SARS-CoV(2003年)、MERS-CoV(2012年)再次进入公众视野,SARS-CoV-2与二者之间在生物学、流行病学及临床诊治上的差异也成为关注的热点。冠状病毒属病毒是遗传物质最大的正链单股RNA病毒,因包膜棘突类似日冕而称为冠状病毒[2],在系统分类上冠状病毒属套式病毒目(Nidovirales)-冠状病毒科(Coronaviridae)-冠状病毒属(Coronavirus)。基因功能研究发现,冠状病毒5’段约2/3基因用于编码非结构性蛋白,这些非结构蛋白形成多聚体,行使复制酶和翻译功能;剩余1/3基因编码四种冠状病毒结构蛋白,包括S蛋白(spike protein)、M蛋白(membrane protein)、E蛋白(envelope protein)和N蛋白(nucleocapsid protein)。非结构蛋白在不同冠状病毒中较为保守,而结构蛋白在与各种宿主的作用中发生多样性变异[3]。在冠状病毒的结构蛋白中,N蛋白与病毒基因组折叠相关,M蛋白和E蛋白功能主要涉及病毒组装,S蛋白的作用主要是识别宿主细胞受体,打开病毒进入细胞的门户。依据目前遗传进化研究,冠状病毒属分为α、β、γ和δ亚家族,γ、δ属宿主主要为鸟类和鱼类,而α、β属主要感染哺乳类动物[4]。SARS-CoV-2、SARS-CoV和MERS-CoV三种冠状病毒均为β属[2]。最新研究[5]显示,SARS-CoV-2在基因序列上的同源性更接近SARS-CoV,熟悉SARS-CoV致病机制及相关研究进展,能为SARS-CoV-2感染的临床诊治研究和疫情防控提供值得借鉴的经验。
1 SARS-CoV-2与SARS-CoV比较自2003年首次鉴定出引起全球卫生警戒的冠状病毒SARS-CoV以来,人类便拉开了与人高致病性冠状病毒抗争的序幕。此后,研究[6]发现,多种与SARS-CoV相似的冠状病毒天然宿主均为蝙蝠。但依然未发现SARS-CoV的直系先祖,推测SARS-CoV可能经历了基因重组进化而来。SARS-CoV基因发生基因重组的高变区是编码S蛋白的序列,该蛋白正是与人体细胞受体相互作用的核心分子[7]。SARS-CoV-2基因序列与SARS-CoV同源性接近80%,二者主要的差异在于开放阅读框ORF1a和编码S蛋白的基因序列[5]。冠状病毒ORF1a编码蛋白与病毒自身复制相关,这些非结构蛋白的功能目前尚未完全明确[8]。冠状病毒S蛋白根据所在位置,分为长的胞外作用域、单链跨膜锚定域和短的胞内短尾结构,而胞外域依据功能又分为受体结合亚基S1和膜融合亚基S2[9]。尽管基因序列上有差异,但结构学分析显示,SARS-CoV-2 S1亚基的RBD区域(与人类细胞受体结合域)与SARS-CoV几乎一样,由此推测SARS-CoV-2可能与SARS-CoV同样通过S蛋白-呼吸道上皮细胞ARE2相互作用进入细胞。其中,RBD区域479和487位点决定了SARS-CoV的组织亲和力和感染进程,动物试验证实这两个位点的改变会导致更快速的畜-人或人-人传播过程[10]。此次SARS-CoV-2与SARS-CoV在S蛋白RBD区域的不同分别位于442、472、479、487和491位点,涵盖了479和487两个位点。最新结构学研究[11]表明,SARS-CoV-2 S蛋白与ACE2受体的亲和力明显高于SARS-CoV S蛋白,SARS-CoV-2组织亲和力以及人际传染性可能远强于SARS-CoV。
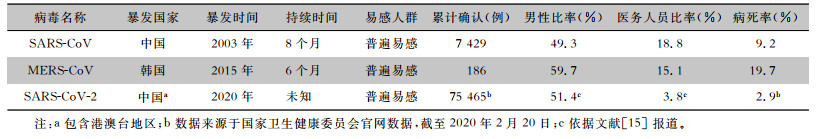
1.1 流行情况对比2019年12月底,湖北省武汉市首次通报发现不明原因肺炎27例,均诊断为病毒性肺炎(病原体不明)。在2020年1月9日中国专家组初步鉴定此次病毒性肺炎病例的病原体为一种新型冠状病毒。截至1月11日,武汉市通报累计报告新型冠状病毒感染病例41例,国内其他地方暂未报告病例;依据国家卫生健康委员会公布数据,截至2020年2月20日全国共累计报告确诊病例75 465例,死亡2 236例(约2.9%),其中湖北地区确诊62 662例,死亡2 144例(约3.4%)。同时,日本、泰国、韩国、美国等国家均发现SARS-CoV-2感染病例,发病特点大多以有疫源地旅居史的患者为中心,呈现聚集性发病。
回顾SARS-CoV流行概况,自2002年11月16日广东省佛山市发现首例病因不明肺炎后,至2003年2月10日,共发现该类患者305例,死亡5例,在感染患者中部分为一线医务工作者[12]。随后,在中国香港、越南、加拿大等地均发现了类似患者。2月28日WHO将在全球众多国家和地区出现类似的传染性非典型肺炎称为严重急性呼吸综合征(severe acute respiratory syndrome,SARS),并于3月12日向全世界发布警报。此后WHO组建了全球实验室网络,3月22日中国香港首次鉴定出导致疾病暴发流行的祸首-冠状病毒[13]。截至2003年8月7日WHO报告疫情涉及32个国家和地区,全球病例合计8 422例,死亡916例(约11.1%),其中亚洲为主要疫区,包括中国和新加坡等,中国大陆报告病例为5 327例,死亡349例(6.6%)[14]。截至2003年9月29日,我国(包含港澳台地区)报告累计病例达7 429例,死亡685例(9.2%)[12]。相较于SARS- CoV,在不到2个月时间SARS-CoV-2感染病例达7万余例,并在多个省、市相继出现,提示SARS-CoV-2有着更强的传染性。SARS-CoV、SARS-CoV-2和MERS-CoV对人类具有高致病性,三种病毒的流行病学资料比较见表 1。
| 表 1 三种人致病性冠状病毒流行病学资料比较 |
|
一般人群对SARS-CoV普遍易感,但低龄儿童感染率相对较低,是否与儿童体内淋巴细胞比例相对较高有关,有待进一步研究。SARS-CoV感染患者和病原携带者(已感染病原体但尚未发病者)为此类疾病的主要传染源[14],其感染患者的临床特点:发热(100%)、乏力不适(70%)、干咳(约70%)、呼吸困难(50%),实验室检查白细胞和淋巴细胞计数稍低[16]。SARS-CoV-2感染患者的主要临床特点包括发热(约90%)、流涕、干咳(80%)、呼吸急促(15%)、呼吸窘迫(20%),大多数患者血液检查白细胞和淋巴细胞计数正常[1]。由此可知,在临床表现上SARS-CoV-2、SARS-CoV感染症状较为相似,仅从临床表型区分鉴别诊断SARS-CoV-2感染相当困难。呼吸功能不全和呼吸衰竭是SARS-CoV-2、SARS-CoV感染者病情加重和死亡的主要原因。诸多的共同点说明SARS-CoV-2感染与SARS-CoV感染在发病机制方面也可能存在相似之处。
体外细胞模型和体内研究[10]均证实,ACE2是SARS-CoV感染人体细胞的功能性受体,SARS-CoV S蛋白通过与呼吸道上皮细胞ACE2蛋白结合,致使病毒双层磷脂与人体细胞膜发生融合,介导病毒进入胞内。对人体组织中ACE2表达情况分析发现,除了动、静脉上皮细胞和动脉平滑肌细胞以外,ACE2在肺泡上皮细胞和小肠上皮细胞分布广泛,这些都可能成为SARS-CoV进入人体组织的通路[17]。对4例因SARS-CoV死亡患者组织学进行分析,发现仅在表达ACE2的肺部和其他组织中检测到SARS-CoV S蛋白及病毒RNA。同样,在这些细胞中也高表达促炎性细胞因子,如MCP-1、TGF-β、TNF-α、IL-1β、IL-6等,未感染细胞则无此现象[18]。动物试验证实,小鼠体内注入SARS-CoV S蛋白会导致急性呼吸衰竭更加恶化,而阻断ACE2相关肾素-血管紧张素通路可明显缓解这种现象,提示ACE2在疾病发生中起关键作用[9]。另外,SARS-CoV感染细胞后能抑制细胞表面ACE2分子表达[19],而在细菌感染性肺炎模型中肺部ACE2表达水平能决定肺部炎症的严重程度,活化的ACE2减少引起促炎性细胞因子CXCL5(C-X-C motif chemokine 5)、MIP2(macrophage inflammatory protein-2)、KC (C-X-C motif chemokine 1)、TNF-α等释放,导致大量的中性粒细胞浸润以及过度的炎性反应[20-21]。病理学检测[22]显示,死亡患者肺泡内明显炎性细胞渗出,肺泡上皮细胞大量脱落与增生,其中均可见病毒颗粒。此外,SARS-CoV致病机制可能与机体固有免疫系统活化紧密相关[23]。对COVID-19死亡患者病理学研究发现,患者主要为肺部损伤,表现为肺泡脱屑和透明膜形成,这些病理改变与SARS极为相似[24]。已有的研究结论有助于了解COVID-19的发病机制,目前,引起疾病发生、发展的病理和生理过程也还在继续研究中。
2 诊疗进展徐小元等[16]研究显示,SARS-CoV感染潜伏期中位日数为6(1~20)d,初期患者100%出现发热,并有肌肉痛,全身不适等常见病毒感染症状;起病后1~2周达极期,患者体温继续升高,呼吸道症状如干咳、胸闷、气短等陆续出现,肺部胸片可见炎性渗出,发展迅速。患者死亡的高危因素包括:年龄大,糖尿病、心脏病等基础疾病者。除此之外,患者血液淋巴细胞越低者,普遍预后较差。王鸣等[25]对广州地区SARS患者回顾性调查显示,病毒感染发病潜伏期、临床症状等与北京地区基本一致,死亡患者40岁以上者占比约80%,其中原有基础疾病者约39%。目前,关于SARS-CoV-2流行病学研究[26]显示,COVID-19潜伏期中位日数为3(0~24)d,人群普遍易感,患者的中位年龄为47岁,男性占比50.1%,绝大部分患者有流行病学史,这些特点与SARS类似,均因密切接触发病;最常见的临床症状为发热(87.9%)和咳嗽(67.7%),部分患者出现如腹泻、乏力、气促等症状。在SARS-CoV-2感染患者中,同样发现淋巴细胞数目减少与病情严重程度和预后密切相关,提示淋巴细胞检测在病情评估中有重要的应用价值[24]。
除了依据患者流行病学史、临床症状和肺部影像学检查外,实验室检查确定病原体是明确COVID-19诊断的主要手段。基于三代基因测序技术的应用,武汉不明原因肺炎在发生10余天即明确致病病原体,并向国内外公开测序数据,为实现疾病快速、精准诊断提供了基础。利用免疫学技术检测特异性抗体,需要一段时间开发、制备相关抗体;而利用RT-PCR技术直接检测病原体基因则更为快速、便捷,对于早期诊断意义重大[27]。基于PCR技术的检测方法存在一定的漏检率,目前迫切需要开发新的诊断方法,以协助提高病原体检测的敏感性和特异性。
目前研究仍未阐明COVID-19发病机制,尚无明确的药物应用,临床治疗多以对症、支持为主。既往SARS治疗中,除支持治疗和辅助通气外,抗病毒药物、糖皮质激素和中成药的应用也引起了许多学者的关注。使用过的抗病毒药物包括抗艾滋病病毒药洛匹那韦/利托那韦(亦称克力芝)、IFN-α和IFN-β。研究[28-29]认为,上述三种药物在临床治疗中均可显著改善SARS-CoV、MERS-CoV感染患者的预后,但确切的疗效仍需要进一步的临床数据研究。此外,研究[30]发现,一种新型核苷类似物抗病毒药Remdesivir(RDV,GS-5734)能有效抑制蝙蝠来源的冠状病毒复制,包括SARS-CoV与MERS-CoV,在冠状病毒肺炎动物模型中能降低病毒载量,并改善患者呼吸功能不全等症状。目前,上述药物治疗SARS-CoV-2感染病例的效果还有待进一步研究。除抗病毒药物以外,李兴旺等[31]研究了SARS重症患者应用糖皮质激素的疗效,发现糖皮质激素能明显减轻患者肺部感染中毒症状。值得注意的是,应用糖皮质激素,患者会出现血糖升高和白蛋白下降,并且大剂量应用糖皮质激素明显增加二重感染的发生[32]。SARS患者应用糖皮质激素治疗后,股骨头坏死的发生率高达53.5%,其中90%为治疗后3~6个月内发病,多数患者无明显临床症状而是通过影像学检查被发现[33]。其他学者的研究发现了相似的现象,提示SARS-CoV-2感染患者应用糖皮质激素应提高警惕,早期发现、减轻后遗症[34]。在中成药治疗方面,陆海英等[35]对北京地区37例SARS患者应用复方甘草酸苷治疗后发现,该复方制剂能够缓解患者肺部症状,减少糖皮质激素用量以及住院日数,此或许对治疗SARS-CoV-2感染者同样有指导意义。此外,在国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》中,明确了中药方剂在COVID-19治疗中的应用策略。
3 总结截至目前,COVID-19疫情发生已2个月,科学技术的发展虽然为快速诊断病原体提供了技术保障,然而,交通便利也对传染性疾病的疫情管控带了前所未有的挑战。在SARS发病初期,病例主要集中局部暴发,如医院内,家庭内等,随着控制手段的加强,疾病后期以散发病例为主。因此,控制传染源与切断传播途径依然是管控疫情的基本手段。针对这些特点,国家采取对应的联防联控措施,有效的遏制了病毒扩散[36]。作为新发传染病,SARS-CoV-2疫情暴发与流行给全球公共卫生健康都带来了重大的威胁,从SRAS的发生到MERS,再到今日COVID-19,冠状病毒似乎并未与人类渐行渐远,反而对人类的影响更加显著[2]。随着人类对自然界的开发日益深入,与冠状病毒的抗争任重道远。目前,对这种RNA病毒的认识仍然有限,还有诸多的问题迫切需要解决,如病毒的进化起源、致病机制、病毒检测、药物和疫苗研发等[37],均有待深入研究。
| [1] |
Hui DS, Azhar EI, Madani TA, et al. The continuing 2019-nCoV epidemic threat of novel coronaviruses to global health-The latest 2019 novel coronavirus outbreak in Wuhan, China[J]. Int J Infect Dis, 2020, 91: 264-266. DOI:10.1016/j.ijid.2020.01.009 |
| [2] |
Cui J, Li F, Shi ZL. Origin and evolution of pathogenic coronaviruses[J]. Nat Rev Microbiol, 2019, 17(3): 181-192. DOI:10.1038/s41579-018-0118-9 |
| [3] |
Chen Y, Liu Q, Guo D. Emerging coronaviruses:Genome structure, replication, and pathogenesis[J]. J Med Virol, 2020, 92(4): 418-423. DOI:10.1002/jmv.25681 |
| [4] |
Woo PCY, Lau SKP, Lam CSF, et al. Discovery of seven novel mammalian and avian coronaviruses in the genus deltacoronavirus supports bat coronaviruses as the gene source of alphacoronavirus and betacoronavirus and avian coronaviruses as the gene source of gammacoronavirus and deltacoronavirus[J]. J Virol, 2012, 86(7): 3995-4008. DOI:10.1128/JVI.06540-11 |
| [5] |
Xu X, Chen P, Wang J, et al. Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission[J/OL]. Sci China Life Sci, 2020 Jan 21. DOI: 10.1007/s11427-020-1637-5[Epubaheadofprint].
|
| [6] |
丁彦青, 王慧君, 申洪, 等. 严重急性呼吸综合征病原体检测及临床病理学观察[J]. 中华病理学杂志, 2003, 32(3): 195-200. DOI:10.3760/j.issn:0529-5807.2003.03.002 |
| [7] |
Li W, Moore MJ, Vasilieva N, et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus[J]. Nature, 2003, 426(6965): 450-454. DOI:10.1038/nature02145 |
| [8] |
Li F. Structure, function, and evolution of coronavirus spike proteins[J]. Annu Rev Virol, 2016, 3(1): 237-261. DOI:10.1146/annurev-virology-110615-042301 |
| [9] |
Kuba K, Imai Y, Rao S, et al. A crucial role of angiotensin converting enzyme 2 (ACE2) in SARS coronavirus-induced lung injury[J]. Nat Med, 2005, 11(8): 875-879. DOI:10.1038/nm1267 |
| [10] |
Wrapp D, Wang N, Corbett KS, et al. Receptor and viral determinants of SARS-coronavirus adaptation to human ACE2[J]. EMBO J, 2005, 24(8): 1634-1643. DOI:10.1038/sj.emboj.7600640 |
| [11] |
Wrapp D, Wang N, Corbett KS, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation[J]. Science, 2020 Feb 19. pii: eabb2507. DOI: 10.1126/science.abb2507[Epubaheadofprint].
|
| [12] |
罗会明, 何剑峰, 汤洪伟. SARS的流行病学特征[J]. 华南预防医学, 2004, 30(1): 61-64. |
| [13] |
芮伟, 张其鹏, 石磊, 等. SARS冠状病毒基因组、蛋白质与侵入宿主细胞过程的研究近况[J]. 中华医学杂志, 2003, 83(11): 913-921. DOI:10.3760/j:issn:0376-2491.2003.11.005 |
| [14] |
中华医学会. 传染性非典型肺炎(SARS)诊疗方案[J]. 中华医学杂志, 2003, 83(19): 1731-1752. |
| [15] |
中国疾病预防控制中心新型冠状病毒肺炎应急响应机制流行病学组. 新型冠状病毒肺炎流行病学特征分析[J]. 中华流行病学杂志, 2020, 41(2): 145-151. DOI:10.3760/cma.j.issn.0254-6450.2020.02.003 |
| [16] |
徐小元, 王广发, 陆海英, 等. SARS临床分期及各期治疗要点的经验总结[J]. 北京大学学报(医学版), 2003, 35(zl): 5-6. |
| [17] |
Hamming I, Timens W, Bulthuis ML, et al. Tissue distribution of ACE2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis[J]. J Pathol, 2004, 203(2): 631-637.
|
| [18] |
He L, Ding Y, Zhang Q, et al. Expression of elevated levels of pro-inflammatory cytokines in SARS-CoV-infected ACE2+ cells in SARS patients:relation to the acute lung injury and pathogenesis of SARS[J]. J Pathol, 2006, 210(3): 288-297. DOI:10.1002/path.2067 |
| [19] |
Glowacka I, Bertram S, Herzog P, et al. Differential downregulation of ACE2 by the spike proteins of severe acute respiratory syndrome coronavirus and human coronavirus NL63[J]. J Virol, 2010, 84(2): 1198-1205. DOI:10.1128/JVI.01248-09 |
| [20] |
Sodhi CP, Wohlford-lenane C, Yamaguchi Y, et al. Attenuation of pulmonary ACE2 activity impairs inactivation of des-Arg9 bradykinin/BKB1R axis and facilitates LPS-induced neutrophil infiltration[J]. Am J Physiol Lung Cell Mol Physiol, 2018, 314(1): L17-L31. DOI:10.1152/ajplung.00498.2016 |
| [21] |
Sodhi CP, Nguyen J, Yamaguchi Y, et al. A dynamic variation of pulmonary ACE2 is required to modulate neutrophilic inflammation in response to Pseudomonas aeruginosa lung infection in mice[J]. J Immunol, 2019, 203(11): 3000-3012. DOI:10.4049/jimmunol.1900579 |
| [22] |
丁彦青, 王慧君, 申洪, 等. 严重急性呼吸综合征病原体检测及临床病理学观察[J]. 中华病理学杂志, 2003, 32(3): 195-200. DOI:10.3760/j.issn:0529-5807.2003.03.002 |
| [23] |
Totura AL, Baric RS. SARS coronavirus pathogenesis:host innate immune responses and viral antagonism of interferon[J]. Curr Opin Virol, 2012, 2(3): 264-275. DOI:10.1016/j.coviro.2012.04.004 |
| [24] |
Xu Z, Shi L, Wang Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome[J]. Lancet Respir Med, 2020, pii:S2213-2600(20): 30076-X. |
| [25] |
王鸣, 杜琳, 周端华, 等. 广州市传染性非典型肺炎流行病学及预防控制效果的初步研究[J]. 中华流行病学杂志, 2003, 24(5): 353-357. DOI:10.3760/j.issn:0254-6450.2003.05.008 |
| [26] |
Guan WJ, Ni ZY, Hu Y, et al. Clinical characteristics of 2019 novel coronavirus infection in China[J/OL]. MedRxiv, 2020 Feb 09. DOI: https://doi.org/10.1101/2020.02.06.20020974.
|
| [27] |
朱沛轩. SARS病原体特征与临床实验室诊断[J]. 国外医学(分子生物学分册), 2003, 25(4): 193-196. DOI:10.3870/j.issn.1672-8009.2003.04.001 |
| [28] |
Sheahan TP, Sims AC, Leist SR, et al. Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV[J]. Nat Commun, 2020, 11(1): 222. |
| [29] |
Chan JF, Yao Y, Yeung ML, et al. Treatment with lopinavir/ritonavir or interferon-β 1b improves outcome of MERS-CoV infection in a nonhuman primate model of common marmoset[J]. J Infect Dis, 2015, 212(12): 1904-1913. DOI:10.1093/infdis/jiv392 |
| [30] |
Sheahan TP, Sims AC, Graham RL, et al. Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses[J/OL]. Sci Transl Med, 2017 Jan 28. pii: eaal3653. DOI: 10.1126/scitranslmed.aal3653.
|
| [31] |
李兴旺, 蒋荣猛, 郭嘉祯. 糖皮质激素治疗重症急性呼吸综合征初探[J]. 中华内科杂志, 2003, 42(6): 378-381. DOI:10.3760/j.issn:0578-1426.2003.06.007 |
| [32] |
徐军, 于学忠. 糖皮质激素对SARS患者股骨头坏死的研究[J]. 中华急诊医学杂志, 2004, 13(10): 697-699. DOI:10.3760/j.issn:1671-0282.2004.10.016 |
| [33] |
陈卫衡, 张强, 刘道兵, 等. SARS并发股骨头坏死的发病特点分析及临床意义[J]. 中国骨伤, 2004, 17(7): 388-390. DOI:10.3969/j.issn.1003-0034.2004.07.002 |
| [34] |
王武, 张雪哲, 卢延. MRI观察SARS患者激素治疗后骨缺血性坏死改变[J]. 中华放射学杂志, 2004, 38(3): 236-239. DOI:10.3760/j.issn:1005-1201.2004.03.003 |
| [35] |
陆海英, 霍娜, 王广发, 等. 复方甘草酸苷治疗传染性非典型肺炎(SARS)的临床研究[J]. 中国药房, 2003, 14(10): 610-611. DOI:10.3969/j.issn.1001-0408.2003.10.015 |
| [36] |
罗会明, 余宏杰, 倪大新, 等. 传染性非典型肺炎的病因研究和现场调查思路[J]. 中华流行病学杂志, 2003, 24(5): 336-339. DOI:10.3760/j.issn:0254-6450.2003.05.002 |
| [37] |
Song Z, Xu Y, Bao L, et al. From SARS to MERS, thrusting coronaviruses into the spotlight[J/OL]. Viruses, 2019, 11(1), pii: E59. DOI: 10.3390/v11010059.
|



