咽峡炎链球菌群(Streptococcus anginosus group, SAG)也被称作米勒链球菌群(Streptococcus milleri group),主要包括咽峡炎链球菌(Streptococcus anginosus)、中间链球菌(Streptococcus intermedius)及星座链球菌(Streptococcus conste-llatus)。SAG通常定植在口腔内,并可从口腔散播至喉部、鼻咽部、胃肠道及泌尿生殖道等。
在二十世纪九十年代前,对于SAG感染的诊断主要依赖于基于生化反应的表型鉴定。而鉴定系统如API 20 Strep、API Rapid 32 ID Strep及VITEKR 2等只能对SAG进行菌群水平鉴定,不能进行精确的菌种水平鉴定[1]。实时聚合酶链反应(real-time PCR)、快速微阵列检测、基质辅助激光解吸电离飞行时间质谱分析或第二代基因组测序等分子技术可对SAG进行菌种水平的精确鉴定[2-3]。因此,SAG长久以来被视为人类正常菌群,在感染性疾病中被严重忽视。诊断技术及分子微生物学技术的快速发展使得日益增多的病例报道证实SAG与多种致命性感染性疾病相关。来自口腔菌斑或牙源性脓肿的SAG可直接播散至机体其他部位,引起化脓性感染及脓肿形成[4-6]。因此,本文将回顾SAG作为机会致病菌的相关证据及其相关致病机制。
1 SAG相关疾病 1.1 菌血症研究表明SAG菌血症发病率呈上升趋势,1989—2000年的流行病学研究结果显示SAG菌血症发病率为0.93/10万[7];而2010—2017年SAG引发的血流感染年发病率为3.7/10万[8]。但需要注意,这一数据的上升也可能与检测技术的发展相关。
1.2 化脓性感染及脓肿SAG可导致机体多种器官感染,其中60%以上的病例为化脓性感染或伴发脓肿形成[9-11]。最常见的感染部位为腹腔、皮肤软组织和头颈部[9-10, 12]。SAG引发的感染相比其他致病菌病程更长,通常需要手术干预才能治愈,总体致死率为2.2%~6%[9, 12-13]。SAG感染好发于青壮年,但也可见于儿童及老年人,尤其多见于男性[12-14]。在成人及儿童SAG感染分离标本中,咽峡炎链球菌的分离率最高(39%~69%),其次为星座链球菌(17.1%~46%),中间链球菌最为少见(6.9%~27%)[10-12, 14]。三种病原菌具有不同的临床感染特征:咽峡炎链球菌在胃肠道及泌尿生殖道感染中更为常见;星座链球菌主要见于呼吸道感染;中间链球菌则常见于头颈部及中枢神经系统等深部组织感染及脓肿形成[15-18]。此外,中间链球菌常作为单一病原菌引发感染,而咽峡炎链球菌及星座链球菌常与其他病原菌引发混合感染[11, 13]。实质性肿瘤、血液系统恶性肿瘤、2型糖尿病、中枢系统疾病、慢性肾衰竭、慢性呼吸系统疾病、病毒性肝炎、结缔组织疾病及口腔感染性疾病等均是SAG感染的风险因素[12, 19-21]。
1.3 头颈部疾病SAG具有扩散到头颈部的潜力,能够引发扁桃体周围脓肿、上颌窦炎等化脓性感染,由于与中枢神经系统距离较近需格外注意。扁桃体周围脓肿是一种急性咽部感染,在青壮年中最为常见,是急性扁桃体炎或扁桃体周围蜂窝织炎最常见的局部并发症。在扁桃体周围脓肿中,除A族链球菌外,SAG是最常见的需氧致病菌[22]。慢性上颌窦炎是口腔感染引发的继发性感染,是常见的头颈部疾病。上颌窦炎可导致细菌感染的局部播散,引发眶周或眼眶蜂窝织炎、海绵窦血栓形成、硬膜下脓肿或脑脓肿等并发症。咽峡炎链球菌感染相关的急性复杂性上颌窦炎发病率呈上升趋势。一项2010—2016年的回顾性队列研究[23]显示,在160例急性复杂性上颌窦炎儿童病例中,半数以上伴有颅内感染并发症的病例中分离出咽峡炎链球菌。伴有咽峡炎链球菌感染的儿童患者颅内并发症发病率更高,需要进行神经系统手术干预的需求更高,抗菌药物治疗及住院时间更长,入住重症监护病房的需求更高[23]。另外一项回顾性研究[24]也发现在鼻窦炎伴有颅内并发症的儿童病例中,42%是由咽峡炎链球菌感染导致。除咽峡炎链球菌,我国近期病例报道发现中间链球菌也可引发儿童患者额窦炎及上颌窦炎,并导致急性硬膜下脓肿[25]。
1.4 脑脓肿脑脓肿可由颅内感染(如骨髓炎、上颌窦炎及硬脑膜下积脓)、神经手术操作等创伤或血源性播散(如细菌性心内膜炎)引发。在1960年以前,葡萄球菌被认为是脑脓肿的主要病原菌。但近年来,越来越多的病例报道发现SAG成为脑脓肿的主要病原菌,其中中间链球菌最为常见[26-28]。英国的一项回顾性研究[29]报道,2013年1月—2016年12月47例成年脑脓肿患者中,39例进行了微生物学诊断,69%(27例)由SAG感染引起,其中中间链球菌的分离率为70%(19/27)。除成人外,SAG引发的脑脓肿还可见于儿童患者。美国一项单中心回顾性研究[30]报道了2014—2020年发生的5例儿童脑脓肿病例,在神经手术操作中获取的细菌培养物中4例分离出中间链球菌,1例分离出星座链球菌,其中1例8岁男童患者由于诊断不及时死于脑疝。
1.5 肺部疾病SAG还可通过口腔分泌物吸入、创伤或手术直接定植、周围组织扩散或血液传播进入肺部,引起肺炎、肺脓肿及脓气胸等肺部疾病[31-33]。在SAG成员中,星座链球菌最常见于肺部感染[31-32]。SAG占社区获得性肺炎病原菌的2%~12%,尤其好发于老年人[34]。约有4%的社区获得性肺炎是坏死性的,急性坏死性肺炎的常见病原菌为金黄色葡萄球菌(Staphylococcus aureus)。但近期研究[35]发现,SAG也可导致快速破坏性肺部感染从而引发患者的重度损伤。与其他病原菌感染不同,SAG能够穿过筋膜平面并引起暴发性感染。因此,SAG感染导致的坏死性肺炎及肺部脓肿通常进展迅速并常伴有脓胸等并发症,对抗菌药物保守治疗效果不佳,需要进行最终的手术干预[34]。对SAG引发的肺部感染进行早期诊断具有重要临床意义。
1.6 心血管疾病细菌性心包炎通常是由于周围胸腔内组织感染扩散,包括肺部、心肌及隔膜下感染的直接扩散或机体远处器官血液播散导致的继发性感染[36]。其中来自肺炎或脓胸导致的感染占大多数,而没有潜在感染源的原发性心包炎极为罕见[37]。原发性化脓性心包炎发展快且病死率高,很多病例在患者死亡后才得到诊断。即使得到及时治疗,其病死率仍高达20%~30%[38]。1984—2017年,已有22例细菌性心包炎被报道是由SAG感染引发,其中5例是由中间链球菌引起[39]。近年来SAG感染引发的原发性心包炎病例也被持续报道[38-40]。除此,SAG还可导致感染性心内膜炎。感染性心内膜炎是临床最难诊断、治疗且最致命的感染性疾病之一。有40%~50%的患者需要进行瓣膜手术,在诊断后1年内致死率为20%~25%。在高收入国家中,感染性心内膜炎的病原菌主要为葡萄球菌及肠球菌,然而链球菌在发展中国家仍是感染性心内膜炎的主要病原菌之一[41]。一项多中心研究[42]发现,在5 336例心内膜炎病例中,72例(1.4%)由SAG引发;其中,咽峡炎链球菌分离率最高。尽管SAG引起的心内膜炎并不多见,但病情严重[43]。因此,提高对SAG分离的重视度,有助于快速诊断、正确的治疗及早期预防并发症。
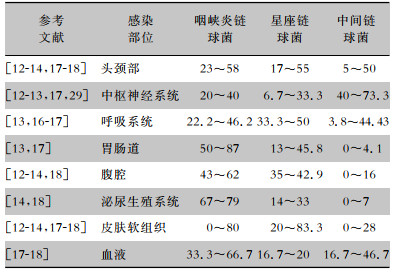
1.7 肝脓肿口腔感染性疾病或口腔操作引发的一过性菌血症可导致定植于口腔的SAG播散至肝脏,并引发肝脓肿[44]。化脓性肝脓肿(pyogenic li-ver abscess, PLA)是一种发展快速的致死性疾病,如不能及时诊断,其致死率极高。PLA可引发严重的并发症包括气腹、感染扩散至脑部及感染性心内膜炎。SAG是PLA的主要病原菌,其中星座链球菌及中间链球菌更常见于肝脓肿[19, 45]。SAG引发的PLA还可导致肝破裂及继发性心包炎等严重并发症[46]。不同部位SAG感染各菌种分离率见表 1。
| 表 1 不同部位SAG感染各菌种分离率(%) |
|
链球菌感染主要包括三个阶段,分别为黏附、侵入及定植于机体组织。在链球菌属中已发现超过一百种毒力因子,这些毒力因子能够协助其完成黏附、侵入及定植于机体等过程,从而引发感染等疾病。对SAG临床分离菌株进行泛基因组测序发现,在SAG中存在55种毒力因子相关基因。其中咽峡炎链球菌携带30~34种毒力基因,16种毒力基因广泛存在于所有SAG成员[47]。
一些机体组织成分,如纤维连接蛋白、纤维蛋白原、胶原蛋白、层黏连蛋白及一些其他细胞外基质蛋白是细菌黏附的主要对象。一方面,SAG能够分泌一系列的毒力因子与纤维连接蛋白、纤维蛋白原、胶原蛋白及层黏连蛋白等分子结合。例如,在咽峡炎链球菌菌株(NCTC 10713)中存在纤连蛋白结合蛋白编码基因fbp62[48]。这一菌株能够通过纤连蛋白结合蛋白与固定的纤维连接蛋白及上皮细胞结合,而敲除这一基因的变异菌株Δfbp62失去结合能力。除此,Δfbp62变异菌株小鼠感染模型中的致死率及脓肿形成明显降低[48]。这些结果证实Fbp62是咽峡炎链球菌重要的毒力因子。除此,SAG细菌表面还存在甘油醛-3-磷酸脱氢酶(glyce-raldehyde-3-phosphate dehydrogenase, GAPDH),也可以与纤维连接蛋白结合。从感染性心内膜炎中分离的咽峡炎链球菌菌株(SLEH753)能够通过与层黏连蛋白结合,表现出对基底膜及瓣膜表面的黏附能力[49]。
另一方面,SAG还可产生多种毒力因子,协助其侵入免疫系统并在组织中存活及定植。多聚糖荚膜是最早发现于链球菌属的毒力因子之一,存在于包括SAG的多种链球菌中,能够协助其黏附至唾液成分、形成生物膜并与其他细菌相互作用。同时,SAG在细菌细胞膜表面还可分泌纤溶酶原结合蛋白,与人类纤溶酶原结合协助细菌侵入机体组织。SAG还可分泌LuxS通过激活自体诱导分子(autoinducer),影响菌斑生物膜的合成。
除此,SAG还可释放与脓肿形成相关的多种毒力因子。例如,SAG分泌的透明质酸酶,其作为一种水解酶,可引起组织液化并形成脓液,增加结缔组织的渗透性进而促进细菌及毒素的播散[50]。与其他的口腔链球菌相比,咽峡炎链球菌产生硫化氢(hydrogen sulfide, H2S)的能力也更强。H2S可由L-半胱氨酸(L-cysteine)产生,与牙周病变密切相关。在BALB/c小鼠背部皮下注射咽峡炎链球菌菌株(FW73)后,小鼠形成牙源性脓肿[51]。当小鼠同时注射咽峡炎链球菌与L-半胱氨酸时,脓肿的平均半径变大,且脓液中lcd(L-半胱氨酸脱巯基酶编码基因)的表达水平比仅注射咽峡炎链球菌的小鼠高15倍。此结果表明L-半胱氨酸脱巯基酶分泌的H2S与小鼠的牙源性脓肿形成相关。除此,肝脓肿分离的中间链球菌菌株可分泌中间链球菌溶素(intermedilysin, ILY),此毒素能够直接破坏宿主细胞。且有研究[52]发现ILY的分泌水平在深部感染部位如脑及肝脓肿中是口腔菌斑中表达水平的6.2~10.2倍,表明此毒素与SAG的致病性密切相关。
SAG还可产生能够引发炎症反应的一系列毒力因子。已有研究[53]证实咽峡炎链球菌临床分离菌株中存在超级抗原及脱氧核糖核酸酶(Dnases)的编码基因。超级抗原能够越过抗原呈递细胞,直接激活T细胞的增殖,从而导致促炎因子的分泌,如干扰素-γ(interferon-gamma, IFN-γ)、肿瘤坏死因子-α(tumour necrosis factor-α, TNF-α)、白介素-1β(interleukin IL-1β, IL-1β)及白介素-6(IL-6)等。而脱氧核糖核酸酶能够通过躲避toll-样受体9(toll-like receptor 9, TLR9)的识别,侵入机体的固有免疫系统并引发细胞因子的分泌。此外,在咽峡炎链球菌菌株中还存在一种新型抗原(Streptococcus anginosus antigen, SAA),此抗原可刺激巨噬细胞产生一氧化氮(NO)及TNF-αmRNA[54]。除此,SAG还可分泌多种毒力因子如PsaA、PavB及Antigen I/I等,这些毒力因子可能也与细菌黏附及侵入机体组织相关,但其具体机制尚不明确[55]。
此外,对多形核白细胞(polymorphonuclear leukocytes, PMNL)杀菌的抵抗能力也是微生物引发脓肿的重要机制。金黄色葡萄球菌被广泛认为是引发化脓性感染的主要病原菌,其能够抵抗人类白细胞的杀菌作用。体外研究[56]发现,SAG周围的PMNL数量超过金黄色葡萄球菌,PMNL对SAG的消灭率仅为金黄色葡萄球菌的3%。此研究结果表明SAG对PMNL具有强大的抵抗能力。
3 结论目前研究结果已证实SAG可作为机会致病菌,引发机体多器官及组织的化脓性感染及脓肿。早期诊断对于其治疗具有重要意义,因此应提高对细菌培养物中SAG分离的警惕性。尤其对于免疫缺陷或存在基础疾病的患者,口腔疾病是引发SAG感染的重要风险因素,应加强对患者口腔健康的重视。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Pilarczyk-Zurek M, Sitkiewicz I, Koziel J. The clinical view on Streptococcus anginosus group-opportunistic pathogens coming out of hiding[J]. Front Microbiol, 2022, 13: 956677. DOI:10.3389/fmicb.2022.956677 |
| [2] |
Wei YS, Chang YR, Tsai YT, et al. The distribution of cultivable oral anaerobic microbiota identified by MALDI-TOF MS in healthy subjects and in patients with periodontal disease[J]. J Pharm Biomed Anal, 2021, 192: 113647. DOI:10.1016/j.jpba.2020.113647 |
| [3] |
Kozińska A, Seweryn P, Sitkiewicz I. A crash course in sequencing for a microbiologist[J]. J Appl Genet, 2019, 60(1): 103-111. DOI:10.1007/s13353-019-00482-2 |
| [4] |
Sasaki M, Yamaura C, Ohara-Nemoto Y, et al. Streptococcus anginosus infection in oral cancer and its infection route[J]. Oral Dis, 2005, 11(3): 151-156. DOI:10.1111/j.1601-0825.2005.01051.x |
| [5] |
Badar F, Ashraf A, Usman S, et al. Septic shock from multiple intra-abdominal Streptococcus constellatus abscesses unamenable to percutaneous drainage[J]. Arch Clin Cases, 2022, 9(3): 117-120. DOI:10.22551/2022.36.0903.10215 |
| [6] |
李刚, 郭睿, 王文, 等. 2014—2019年咽峡炎链球菌群血流感染临床特点及其耐药性分析[J]. 中国感染与化疗杂志, 2020, 20(5): 476-480. Li G, Guo R, Wang W, et al. Clinical characteristics and antibiotic resistance profiles of Streptococcus anginosus group bloodstream infection from 2014 to 2019[J]. Chinese Journal of Infection and Chemotherapy, 2020, 20(5): 476-480. |
| [7] |
Weightman NC, Barnham MRD, Dove M. Streptococcus milleri group bacteraemia in North Yorkshire, England (1989-2000)[J]. Indian J Med Res, 2004, 119(Suppl)): 164-167. |
| [8] |
Laupland KB, Pasquill K, Parfitt EC, et al. Streptococcus anginosus group bloodstream infections in the western interior of British Columbia, Canada[J]. Infect Dis (Lond), 2018, 50(6): 423-428. DOI:10.1080/23744235.2017.1416163 |
| [9] |
Al Majid F, Aldrees A, Barry M, et al. Streptococcus anginosus group infections: management and outcome at a tertiary care hospital[J]. J Infect Public Health, 2020, 13(11): 1749-1754. DOI:10.1016/j.jiph.2020.07.017 |
| [10] |
Kobo O, Nikola S, Geffen Y, et al. The pyogenic potential of the different Streptococcus anginosus group bacterial species: retrospective cohort study[J]. Epidemiol Infect, 2017, 145(14): 3065-3069. DOI:10.1017/S0950268817001807 |
| [11] |
Claridge JE 3rd, Attorri S, Musher DM, et al. Streptococcus intermedius, Streptococcus constellatus, and Streptococcus anginosus ("Streptococcus milleri group") are of different clinical importance and are not equally associated with abscess[J]. Clin Infect Dis, 2001, 32(10): 1511-1515. DOI:10.1086/320163 |
| [12] |
Jiang SH, Li M, Fu T, et al. Clinical characteristics of infections caused by Streptococcus anginosus group[J]. Sci Rep, 2020, 10(1): 9032. DOI:10.1038/s41598-020-65977-z |
| [13] |
何小亮, 黄晓霞, 王翠, 等. 2019—2021年咽峡炎链球菌群化脓性感染临床特点及其耐药性分析[J]. 中国感染与化疗杂志, 2023, 23(5): 600-604. He XL, Huang XX, Wang C, et al. Clinical characteristics and antibiotic resistance profiles of pyogenic infections caused by Streptococcus anginosus group from 2019 to 2021[J]. Chinese Journal of Infection and Chemotherapy, 2023, 23(5): 600-604. |
| [14] |
Ismail K, Hughes I, Moloney S, et al. Streptococcus anginosus group infections in hospitalised children and young people[J]. J Paediatr Child Health, 2022, 58(5): 809-814. DOI:10.1111/jpc.15840 |
| [15] |
Furuichi M, Horikoshi Y. Sites of infection associated with Streptococcus anginosus group among children[J]. J Infect Chemother, 2018, 24(2): 99-102. DOI:10.1016/j.jiac.2017.09.011 |
| [16] |
李岷, 姜鲁宁, 蒋胜华. 肺咽峡炎链球菌群感染患者的临床特征[J]. 中华医学杂志, 2020, 100(20): 1578-1581. Li M, Jiang LN, Jiang SH. Clinical analysis of chest infections caused by Streptococcus anginosus group[J]. National Medical Journal of China, 2020, 100(20): 1578-1581. DOI:10.3760/cma.j.cn112137-20191204-02635 |
| [17] |
胡惠丽, 董方, 宁雪, 等. 咽峡炎链球菌群感染患儿119例病例系列报告[J]. 中国循证儿科杂志, 2020, 15(2): 125-129. Hu HL, Dong F, Ning X, et al. Streptococcus anginosus group infection in 119 children: a case series report[J]. Chinese Journal of Evidence Based Pediatrics, 2020, 15(2): 125-129. |
| [18] |
Bantar C, Fernandez Canigia L, Relloso S, et al. Species belonging to the "Streptococcus milleri" group: antimicrobial susceptibility and comparative prevalence in significant clinical specimens[J]. J Clin Microbiol, 1996, 34(8): 2020-2022. DOI:10.1128/jcm.34.8.2020-2022.1996 |
| [19] |
Reyes JVM, Dondapati M, Ahmad S, et al. A case report of multiple abscesses caused by Streptococcus intermedius[J]. Clin Case Rep, 2023, 11(1): e6813. DOI:10.1002/ccr3.6813 |
| [20] |
王凯歌, 谢轶, 田攀文, 等. 咽峡炎链球菌群胸腔感染患者的临床分析[J]. 中华结核和呼吸杂志, 2021, 44(8): 738-740. Wang KG, Xie Y, Tian PW, et al. Clinical analysis of thoracic infections caused by Streptococcus anginosus group[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2021, 44(8): 738-740. DOI:10.3760/cma.j.cn112147-20210527-00356 |
| [21] |
李莉, 杨琴, 陈杰华, 等. 咽峡炎链球菌致儿童脓肿性疾病8例临床分析[J]. 中国感染与化疗杂志, 2021, 21(2): 185-188. Li L, Yang Q, Chen JH, et al. Clinical analysis of the abscesses caused by Streptococcus anginosus in children[J]. Chinese Journal of Infection and Chemotherapy, 2021, 21(2): 185-188. |
| [22] |
Galioto NJ. Peritonsillar abscess[J]. Am Fam Physician, 2017, 95(8): 501-506. |
| [23] |
Troy E, Sillau S, Bernard TJ, et al. Incidence and clinical outcomes of Streptococcus anginosus in acute complicated sinusitis: a pediatric cohort[J]. J Pediatric Infect Dis Soc, 2021, 10(2): 168-171. DOI:10.1093/jpids/piz098 |
| [24] |
Din-Lovinescu C, Mir G, Blanco C, et al. Intracranial complications of pediatric rhinosinusitis: identifying risk factors and interventions affecting length of hospitalization[J]. Int J Pe-diatr Otorhinolaryngol, 2020, 131: 109841. DOI:10.1016/j.ijporl.2019.109841 |
| [25] |
高佳堆, 杜思凝, 李苏宇, 等. 源于中间链球菌性额窦炎及上颌窦炎导致的儿童急性硬膜下脓肿1例[J]. 中国实验诊断学, 2021, 25(9): 1422-1423. Gao JD, Du SN, Li SY, et al. Acute subdural abscess secondary to frontal sinusitis and maxillary sinusitis caused by Streptococcus intermedius in children: a case report[J]. Chinese Journal of Laboratory Diagnosis, 2021, 25(9): 1422-1423. DOI:10.3969/j.issn.1007-4287.2021.09.051 |
| [26] |
Shibamura N, Miyamori D, Tanabe T, et al. Focal neurological symptoms at initial presentation could be a potential risk factor for poor prognosis among patients with multiple brain abscesses by Streptococcus anginosus group: a case report with literature review[J]. Cureus, 2022, 14(11): e32085. |
| [27] |
Isern RD 3rd, Toth S, Goldfarb M, et al. Multifocal brain abscesses due to Streptococcus intermedius[J]. Cureus, 2022, 14(12): e32797. |
| [28] |
Suzuki T, Morioka S, Nomoto H, et al. Disseminated Streptococcus anginosus invasive infection with intracranial subdural abscess formation[J]. J Infect Chemother, 2022, 28(5): 696-698. DOI:10.1016/j.jiac.2021.12.016 |
| [29] |
Darlow CA, McGlashan N, Kerr R, et al. Microbial aetiology of brain abscess in a UK cohort: prominent role of Streptococcus intermedius[J]. J Infect, 2020, 80(6): 623-629. DOI:10.1016/j.jinf.2020.03.011 |
| [30] |
Madathil S, Matsumoto S, Mathews KD, et al. Central ner-vous system infections due to Streptococcus anginosus group: a single-center case series[J]. J Child Neurol, 2022, 37(3): 210-217. DOI:10.1177/08830738211052132 |
| [31] |
Zhang ZR, Xiao BB, Liang ZX. Successful treatment of pyopneumothorax secondary to Streptococcus constellatus infection with linezolid: a case report and review of the literature[J]. J Med Case Rep, 2020, 14(1): 180. DOI:10.1186/s13256-020-02475-w |
| [32] |
Vulisha AK, Sam R, Nur H, et al. Aggressive presentation of Streptococcus constellatus[J]. Cureus, 2021, 13(4): e14534. |
| [33] |
Tatara Y, Niimura T, Mihara H. Paraparesis and bilateral pulmonary abscesses secondary to pyogenic spondylodiscitis caused by Streptococcus anginosus group bacteria[J]. Spine Surg Relat Res, 2019, 4(2): 190-191. |
| [34] |
Gonzalez LM, Nessa L, Sanivarapu R, et al. Streptococcus anginosus lung abscess with complicated parapneumonic empyema[J]. Cureus, 2023, 15(4): e37506. |
| [35] |
Saha BK. Rapidly progressive necrotizing pneumonia: remember the Streptococcus anginosus group![J]. Pan Afr Med J, 2020, 36: 116. |
| [36] |
Cai QJ. Streptococcus anginosus purulent pericarditis with cardiac tamponade after coronary artery bypass surgery[J]. BMJ Case Rep, 2020, 13(8): e235862. DOI:10.1136/bcr-2020-235862 |
| [37] |
Khor SY, Osman AF, Agarwal P, et al. Streptococcus anginosus purulent pericarditis with cardiac tamponade presenting as a complication of postobstructive pneumonia[J]. BMJ Case Rep, 2022, 15(6): e249871. DOI:10.1136/bcr-2022-249871 |
| [38] |
Beom JW, Ko Y, Boo KY, et al. A successfully treated case of primary purulent pericarditis complicated by cardiac tamponade and pneumopericardium[J]. Acute Crit Care, 2021, 36(1): 70-74. DOI:10.4266/acc.2020.00234 |
| [39] |
Khan MS, Khan Z, Banglore BS, et al. Primary purulent bacterial pericarditis due to Streptococcus intermedius in an immunocompetent adult: a case report[J]. J Med Case Rep, 2018, 12(1): 27. |
| [40] |
KapaČinskaitė M, Gabartaiteė D, Šatrauskienė A, et al. A rare case of primary purulent pericarditis caused by Streptococcus constellatus[J]. Medicina (Kaunas), 2023, 59(1): 159. |
| [41] |
Habib G, Erba PA, Iung B, et al. Clinical presentation, aetio-logy and outcome of infective endocarditis. Results of the ESC-EORP EURO-ENDO (European infective endocarditis) registry: a prospective cohort study[J]. Eur Heart J, 2019, 40(39): 3222-3232. |
| [42] |
Escrihuela-Vidal F, López-Cortés LE, Escolà-Vergé L, et al. Clinical features and outcomes of Streptococcus anginosus group infective endocarditis: a multicenter matched cohort study[J]. Open Forum Infect Dis, 2021, 8(6): ofab163. |
| [43] |
Kahlon P, Fajardo AF, Mondal T. A rare paediatric case of possible infective endocarditis caused by Streptococcus anginosus[J]. Cardiol Young, 2023, 33(4): 640-642. |
| [44] |
Livingston LV, Perez-Colon E. Streptococcus intermedius bacteremia and liver abscess following a routine dental cleaning[J]. Case Rep Infect Dis, 2014, 2014: 954046. |
| [45] |
Nahidi SM, Hussaini MS, Mahadeo D, et al. Pyogenic liver abscess growing Streptococcus constellatus in an elderly female with recent diverticulitis: a case report[J]. Cureus, 2023, 15(4): e37004. |
| [46] |
Prateepchaiboon T, Akarapatima K, Pisudtinontakul W, et al. A rare case of massive pericardial effusion due to sponta-neous rupture of Streptococcus anginosus group liver abscess[J]. Clin J Gastroenterol, 2020, 13(6): 1258-1264. |
| [47] |
Olson AB, Kent H, Sibley CD, et al. Phylogenetic relationship and virulence inference of Streptococcus anginosus group: curated annotation and whole-genome comparative analysis support distinct species designation[J]. BMC Genomics, 2013, 14: 895. |
| [48] |
Kodama Y, Ishikawa T, Shimoyama Y, et al. The fibronectin-binding protein homologue Fbp62 of Streptococcus anginosus is a potent virulence factor[J]. Microbiol Immunol, 2018, 62(10): 624-634. |
| [49] |
Allen BL, Katz B, Höök M. Streptococcus anginosus adheres to vascular endothelium basement membrane and purified extracellular matrix proteins[J]. Microb Pathog, 2002, 32(4): 191-204. |
| [50] |
Issa E, Salloum T, Tokajian S. From normal flora to brain abscesses: a review of Streptococcus intermedius[J]. Front Microbiol, 2020, 11: 826. |
| [51] |
Takahashi Y, Yoshida A, Nagata E, et al. Streptococcus anginosus l-cysteine desulfhydrase gene expression is associated with abscess formation in BALB/c mice[J]. Mol Oral Microbiol, 2011, 26(3): 221-227. |
| [52] |
Nagamune H, Whiley RA, Goto T, et al. Distribution of the intermedilysin gene among the anginosus group Streptococci and correlation between intermedilysin production and deep-seated infection with Streptococcus intermedius[J]. J Clin Microbiol, 2000, 38(1): 220-226. |
| [53] |
Babbar A, Kumar VN, Bergmann R, et al. Members of a new subgroup of Streptococcus anginosus harbor virulence related genes previously observed in Streptococcus pyogenes[J]. Int J Med Microbiol, 2017, 307(3): 174-181. |
| [54] |
Shimoyama Y, Ishikawa T, Kodama Y, et al. Tyrosine tRNA synthetase as a novel extracellular immunomodulatory protein in Streptococcus anginosus[J]. FEMS Microbiol Lett, 2020, 367(18): fnaa153. |
| [55] |
Kuryłek A, Stasiak M, Kern-Zdanowicz I. Virulence factors of Streptococcus anginosus - a molecular perspective[J]. Front Microbiol, 2022, 13: 1025136. |
| [56] |
Wanahita A, Goldsmith EA, Musher DM, et al. Interaction between human polymorphonuclear leukocytes and Streptococcus milleri group bacteria[J]. J Infect Dis, 2002, 185(1): 85-90. |



