2. 新疆维吾尔自治区胸科医院药剂科, 新疆 乌鲁木齐 830049;
3. 石河子大学医学院第一附属医院药剂科, 新疆 石河子 832008
2. Department of Pharmacy, Chest Hospital of Xinjiang Uyghur Atonomous Region of the PRC, Urumqi 830049, China;
3. Department of Pharmacy, The First Affiliated Hospital of Medical College, Shihezi University, Shihezi 832008, China
抗结核药物所导致肝损伤(anti-tuberculosis drug-induced liver injury,ATDLI)常使抗结核治疗中断,或使治疗方案更改,导致患者疗效降低和结核分枝杆菌产生耐药等,直接影响对结核病的控制效果。随着人们对药物性肝损伤研究的不断深入,参与肝损伤疾病的细胞因子的分泌量越来越引起人们的关注,免疫细胞在活化过程中释放的细胞因子在肝损伤机制中发挥着重要作用[1]。其中白介素-10(interleukin-10,IL-10)是一种重要的细胞因子,有研究报道IL-10作为一种抗炎因子,参与多种免疫炎症的病理过程,肝组织可分泌IL-10对抗细胞色素酶介导的药物免疫毒性和细胞毒性,抑制炎症介质、氧自由基等的释放[2-3]。并且人们发现细胞因子不同的基因型呈现不同的表达量,且不同人群IL-10多态性的分布存在差异[4]。IL-10的分泌量受基因的调控,由于不同种族人群的基因存在差异,因此其IL-10水平亦不同。
全国结核病流行病学调查结果显示,新疆是全国结核病高流行区,不同民族的结核病发病率也存在差异,维吾尔族发病率高于汉族和其他少数民族人群[5]。对此,本项目在等同的实验条件下检测新疆区域内维吾尔族与汉族人群中ATDLI患者IL-10分泌水平,同时与肺结核患者血清IL-10分泌水平比较,从而探讨两民族患者由于病情变化而导致IL-10分泌水平的变化及其在肝损伤中的临床意义。
1 对象与方法 1.1 研究对象纳入石河子大学医学院第一附属医院、新疆维吾尔自治区胸科医院2015年1月—2016年11月确诊为ATDLI患者。维吾尔族为ATDLI患者均筛选新疆区域内原居住者,双亲无异族通婚史。项目通过石河子大学医学院第一附属医院医学伦理委员会批准,患者均签署知情同意书。
1.2 诊断标准 1.2.1 肺结核诊断标准依据中华医学会结核病分会制定的《肺结核诊断和治疗指南》[6]进行肺结核的诊断。
1.2.2 ATDLI患者确诊结核病患者在接受抗结核药物治疗过程中出现肝损伤,并且与抗结核药物的使用直接相关,诊断依据满足《抗结核药所致药物性肝损伤诊断与处理专家建议》[7]的相关条件。
1.2.3 肝损伤严重程度分级标准依据国家食品药品监督管理局(State Food and Drug Administration, SFDA)药品评价中心(Center for Drug Reassessment,CDR)制定的《抗结核药所致药物性肝损伤诊断与处理专家建议》对肝损伤严重程度进行分级[7]。
1.2.4 ATDLI患者纳入标准经确诊的肺结核患者在抗结核药物治疗前临床生化检查均正常,包括血清丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、碱性磷酸酶(AKP)和总胆红素(TBiL)均在正常范围内(ALT<40 U/L,AST<40 U/L,AKP<150 U/L,TBiL<23.1 μmol/L)[8-9]。经抗结核药物治疗且在抗结核药物治疗过程中出现肝损伤,并确保在抗结核药物治疗过程中未合并服用可导致肝损伤的其他药物。
1.2.5 抗结核药物继发肝损伤患者排除标准(1) HIV感染、慢性嗜肝病毒感染的肝炎患者;(2)抗结核治疗前患者ALT、AST或TBiL检测结果非正常参考范围内;(3)合并自身免疫性肝炎、HIV感染、酒精性肝病、肿瘤、糖尿病、心脑血管疾病及其他感染性疾病;(4)由其他药物导致肝功能损伤的患者。
1.3 试剂及仪器IL-10 ELISA试剂盒为R & D公司产品(批号330244),Thermo Varioskan Flash酶标仪为Thermo Scientific公司产品,TGL-16B型离心机为上海安亭科学仪器厂产品,恒温水浴锅为江苏金坛市医疗仪器厂产品。
1.4 研究方法 1.4.1 标本采集在接受抗结核药物治疗过程中发生肝损伤患者于清晨空腹抽取静脉血2 mL,4 000 r/min离心5 min,分离血清,置于-20℃保存待检测。
1.4.2 检测方法采用ELISA试剂盒(IL-10 ELISA Kit)测定肝损伤患者IL-10分泌量,严格按照试剂盒说明书进行操作,应用Thermo Varioskan Flash酶标仪在450 nm处测定OD值,标准曲线浓度分别为:500、250、125、62.5、31.2、15.6、7.8 pg/mL,相关系数(r2)=0.9998,变异系数(CV)=0.0879。在570 nm处波长处进行校正,结果用四参数拟合曲线进行计算,根据标准曲线公式计算出IL-10的浓度。
1.5 统计学处理应用SPSS 17.0统计软件进行数据分析。正态分布的计量资料采用均数±标准差(x±s)表示,组间比较采用独立样本t检验,多组间均数比较采用单因素方差分析;非正态分布计量资料采用M(P25,P75)表示,组间比较采用Mann-Whitney U检验;计数资料比较采用χ2检验。以P≤0.05为差异具有统计学意义。
2 结果 2.1 基本资料本研究共纳入ATDLI汉族组患者100例(男性67例,女性33例),维吾尔族组患者135例(男性73例,女性62例)。年龄18~65岁,汉族组患者平均年龄(38.02±15.77)岁,维吾尔族组患者(40.53±16.44)岁;体重:汉族组(59.35±10.23)kg,维吾尔族组(58.39±12.97)kg;身高:汉族组(168.30±7.98)cm,维吾尔族组(166.02±7.83)cm;ALT:汉族组[127.3(80~394)]U/L,维吾尔族组[113.2(80~450)]U/L;AST:汉族组[156.5(40~360)]U/L,维吾尔族组[135.7(40~432)]U/L;两组患者抗结核药物治疗方案均为异烟肼片(H)+利福平(R)+吡嗪酰胺片(Z)+盐酸乙胺丁醇片(E)或H+R+Z或H+R+E。两组患者的性别构成比较,差异有统计学意义(P<0.05);两组患者的年龄、体重、身高、ALT、AST比较,差异均无统计学意义(P>0.05)。
2.2 汉族与维吾尔族肝损伤患者IL-10分泌量检测显示汉族组、维吾尔族组ATDLI患者IL-10分泌量分别为(45.81±11.04)、(56.30±17.24)pg/mL。维吾尔族组患者高于汉族组患者,差异有统计学意义(t=5.28,P<0.0001)。
2.3 不同性别的汉族、维吾尔族ATDLI患者IL-10分泌水平汉族组、维吾尔族组ATDLI患者不同性别的血清IL-10相比较,差异均无统计学意义(P>0.05)。见表 1。
| 表 1 两个民族不同性别ATDLI患者IL-10分泌量的比较(x±s,pg/mL) Table 1 Comparison in secretion level of serum IL-10 between ATDLI patients of different genders of two nationalities (x±s, pg/mL) |

|
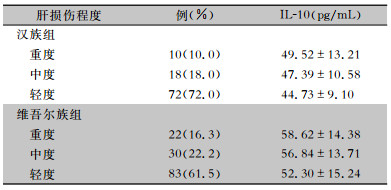
按肝损伤严重程度分级标准,根据ALT值将ATDLI患者分为轻度(ALT值80~120 U/L)、中度(ALT值120~200 U/L)和重度(ALT值>200 U/L)肝损伤三组。汉族组、维吾尔族组ATDLI患者轻度、中度、重度肝损伤构成及IL-10分泌量见表 2。汉族组、维吾尔族组ATDLI患者不同程度肝损伤构成比较,差异无统计学意义(χ2=3.137,P=0.208)。
| 表 2 汉族、维吾尔族ATDLI患者轻度、中度、重度肝损伤构成及IL-10分泌量 Table 2 Constituent and secretion level of IL-10 in Han and Uyghur nationality patients with slight, moderate and severe ATDLI |
|
组间两两比较显示,汉族组、维吾尔族组重度肝损伤患者IL-10的分泌量均高于轻度肝损伤患者(均P<0.05);而中度肝损伤患者与轻度、重度肝损伤患者之间比较,差异均无统计学意义(均P>0.05)。两个民族ATDLI患者随着肝损伤程度加重,抑炎因子IL-10的分泌量逐渐升高。见图 1。
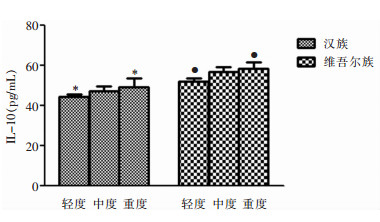 |
| *:汉族轻度组与重度组比较,P<0.05;●:维吾尔族轻度组与重度组比较,P<0.05 图 1 汉族、维吾尔族不同肝损伤程度的ATDLI患者IL-10分泌量的比较(x±s) Figure 1 Comparison in IL-10 secretion level in Han and Uyghur nationality patients with different extent of ATDLI (x±s) |
随着对细胞因子研究的深入,发现在肝损伤的发病机制中,免疫反应中的细胞因子发挥着重要的作用。IL-10的分泌量与结核免疫力缺乏相关,其可调节促炎症因子CD4+T辅助细胞反应[10-11]。并有文献显示IL-10通过多种调节机制参与肝纤维化的发展,在炎症因子所致的肝纤维化中具抗纤维化作用,结果表明慢性肝炎患者血清IL-10浓度高于对照组,且不同损伤程度的患者体内IL-10浓度重度组高于轻度、中度组,认为IL-10参与肝慢性损伤的病理过程,且随着反映肝损伤严重程度的指标升高而升高[12]。本研究结果显示,汉族、维吾尔族ATDLI轻度组患者IL-10分泌量均低于重度组(P<0.05)。并且本课题组前期对254例(汉族132例,维吾尔族122例)肺结核患者在服用抗结核药物治疗后,非ATDLI患者血清IL-10表达水平的研究显示:维吾尔族患者高于汉族[13]。本次对ATDLI患者IL-10分泌水平的研究结果同样是维吾尔族患者高于汉族。将本次结果与前期结果[13]整合分析发现:汉族、维吾尔族ATDLI患者IL-10分泌水平均高于结核病患者(P<0.0001)。反映出IL-10分泌量的增加与药物性肝损伤的发生相关,随着血清ALT、AST的升高,血清IL-10也伴随升高。这也与文献[12]报道的结果吻合。
IL-10的主要生物学功能是抑制和终止体内的炎症反应,对所有的促炎性细胞因子从合成到释放几乎都有抑制作用,参与多种免疫炎症的病理过程[14-15]。研究[16]表明IL-10的分泌水平75%是由遗传决定的,而且主要受转录水平的控制。本项目前期对汉族(124例)、维吾尔族(131例)健康人群IL-10基因多态性与分泌量的相关性研究[17]显示:IL-10的-1082G/A、-819C/T、-592C/A位点基因型在汉族与维吾尔族人群的总体分布均有统计学差异(P<0.001),其中-1082位点的AA型和AG型在两民族间分布有差异,但AA型更显著(OR=5.49),汉族人群AA基因型频率高于维吾尔族人群(P<0.001),汉族-819位点TT基因型和-592位点AA基因型频率的分布高于维吾尔族(P=0.02);维吾尔族人群-1082位点AG型、-819和-592位点CC基因型频率的分布高于汉族(P<0.001)。对各位点等位基因进行卡方检验,发现-1082G/A位点维吾尔族人群等位基因G(25.57%)高于汉族(7.26%),-819C/T和-592C/A位点维吾尔族人群等位基因C(50.38%)高于汉族(32.66%),差异有统计学意义(P<0.001)。
而IL-10启动子区-1082、-819、-592这三个位点基因多态性对体内IL-10水平的变化会产生影响,研究[18]显示-1082位点位于Ets转录因子结合序列,该位点G等位基因体内IL-10水平倾向于高表达,而A等位基因则倾向于IL-10低水平表达。同样前期的结果[17]也证实GCC为高分泌型,ATA为低分泌型,ACC的表达水平介于前两者之间。维吾尔族-1082位点的AG型、-819位点的CC和CT型、-592位点的CC和CA型血清IL-10浓度高于汉族(P<0.05)。体内IL-10的分泌水平主要受遗传因素的调控在不同人群间呈现出差异[19-20]。当携带GCC等位基因型时,IL-10的表达较高;当携带ATA等位基因型时细胞因子IL-10的表达较低。
新疆靠近中亚,作为古丝绸之路的重要通道,由于迁移、婚配等原因使维吾尔族融合有30%左右的高加索人种血缘[21]。与汉族人群在体质和遗传距离上有明显不同[22-23]。本文对汉族与维吾尔族ATDLI患者血清IL-10分泌量的研究显示:维吾尔族患者IL-10的分泌水平高于汉族受试患者,差异有统计学意义(P<0.05),提示这应与两个民族人群的遗传基因多态性相关。由于受试患者的样本数量有限,仅对ATDLI患者IL-10的分泌量进行了探讨,其民族间IL-10分泌水平差异的机制尚需更大群体样本进一步的研究予以证实。
本试验通过检测汉族与维吾尔族ATDLI患者体内IL-10分泌水平,研究其在肝损伤患者体内的变化以及在不同民族间表达水平的差异,将有利于探讨细胞因子在结核病患者体内的表达特点,为疾病的诊断、治疗及愈后观察提供基础数据。
| [1] |
Nelson DR, Lauwers GY, Lau JY, et al. Interleukin 10 treatment reduces fibrosis in patients with chronic hepatitis C:a pilot trial of interferon nonresponders[J]. Gastroenterology, 2000, 18: 655-660. |
| [2] |
Sabat R, Grütz G, Warszawska K, et al. Biology of interleukin-10[J]. Cytokine Growth Factor Rev, 2010, 21(5): 331-344. DOI:10.1016/j.cytogfr.2010.09.002 |
| [3] |
李晨, 邢少军, 段学章, 等. 乙型肝炎肝硬化患者外周血调节性T细胞频率及血清IL-1β、IL-6和IL-10水平的变化[J]. 实用肝脏病杂志, 2012, 15(3): 244-246. DOI:10.3969/j.issn.1672-5069.2012.03.023 |
| [4] |
Van Dyke AL, Cote ML, Wenzlaff AS, et al. Cytokine SNPs:Comparison of allele frequencies by race and implications for future studies[J]. Cytokine, 2009, 46(2): 236-244. DOI:10.1016/j.cyto.2009.02.003 |
| [5] |
杨津明, 杰恩斯·斯马胡勒, 邰新蓉, 等. 新疆维吾尔自治区2010-2011年结核病流行病学抽样调查结果分析[J]. 中国防痨杂志, 2013, 35(12): 960-964. |
| [6] |
中华医学会结核病学分会. 肺结核诊断和指南[J]. 中华结核和呼吸杂志, 2001, 24(1): 70-73. |
| [7] |
中华医学会结核病学分会. 抗结核药所致药物性肝损伤诊断与处理专家建议[J]. 中华结核和呼吸杂志, 2013, 36(10): 732-736. DOI:10.3760/cma.j.issn.1001-0939.2013.10.007 |
| [8] |
麻斌喜, 陈伟岚, 郑甜, 等. 汉族、维吾尔族抗结核药物性肝损害患者血清TNF-α表达水平的研究[J]. 中国医院药学杂志, 2017, 37(24): 2456-2459. |
| [9] |
麻斌喜.新疆维吾尔族、汉族抗结核药物性肝损害患者血清TNF-α表达水平的研究[D].乌鲁木齐: 新疆医科大学, 2017.
|
| [10] |
Hyodo N, Nakamura I, Imawari M. Hepatitis B core antigen stimulates interleukin-10 secretion by both T cells and monocytes from peripheral blood of patients with chronic hepatitis B virus infection[J]. Clin Exp Immunol, 2004, 135: 462-466. DOI:10.1111/cei.2004.135.issue-3 |
| [11] |
黄斌. 98例肺结核患者IL-10和IL-6表达水平的临床研究[J]. 中外医疗, 2013(3): 27-28. DOI:10.3969/j.issn.1674-0742.2013.03.017 |
| [12] |
Iyer SS, Cheng G. Role of Interleukin 10 transcriptional regulation in inflammation and autoimmune disease[J]. Crit Rev Immunol, 2012, 32(1): 23-63. |
| [13] |
王晓义, 谢松松, 程丽, 等. 新疆维吾尔族和汉族肺结核患者白细胞介素-10及人肿瘤坏死因子-α表达水平的比较研究[J]. 中国临床药理学杂志, 2017, 33(22): 2230-2232. |
| [14] |
Bartzeliotou AI, Margeli AP, Tsironi M. Circulating levels of adhesion molecules and markers of endothelial activation in acute inflammation induced by prolonged brisk exercise[J]. Clin Biochem, 2007, 40(11): 765-770. DOI:10.1016/j.clinbiochem.2007.01.013 |
| [15] |
Hoffmann SC, Stanley EM, Darrin Cox E, et al. Association of cytokine polymorphic inheritance and in vitro cytokine production in anti-CD3/CD28-stimulated peripheral blood lymphocytes[J]. Transplantation, 2001, 72(8): 1444-1450. DOI:10.1097/00007890-200110270-00019 |
| [16] |
Westendorp RG, Langermans JA, Huizinga TW, et al. Genetic influence on cytokine production and fatal meningococcal disease[J]. Lancet, 1997, 349(9046): 170-173. DOI:10.1016/S0140-6736(96)06413-6 |
| [17] |
朱雅婷, 魏娟, 张永军, 等. 新疆维吾尔族、汉族人群IL-10基因多态性与分泌量的相关性研究[J]. 中国免疫学杂志, 2013, 29(10): 1022-1027. DOI:10.3969/j.issn.1000-484X.2013.10.003 |
| [18] |
Gallagher PM, Lowe G, Fitzgerald T, et al. Association of IL-10 polymorphism with severity of illness in community acquired pneumonia[J]. Thorax, 2003, 58(2): 154-156. DOI:10.1136/thorax.58.2.154 |
| [19] |
Sainz J, Hassan L, Perez E, et al. Interleukin-10 promoter polymorphism as risk factor to develop invasive pulmonary aspergillosis[J]. Immunol, 2007, 109(1): 76-82. |
| [20] |
Reuss E, Fimmers R, Kruger A, et al. Differential regulation of interleukin-10 production by genetic and environmental factors-a twin study[J]. Genes Immun, 2002, 3(7): 407-413. |
| [21] |
杜若甫. 我国的人类群体遗传学研究[J]. 生物学通报, 1997, 32(7): 9-12. |
| [22] |
艾琼华, 肖辉, 赵建新, 等. 维吾尔族的体质特征研究[J]. 人类学学报, 1993, 12(4): 357-364. |
| [23] |
袁义达, 杜若甫. 中国十七个民族间的遗传距离的初步研究[J]. 遗传学报, 1983, 10(5): 398-405. |



