2. 长沙市第一医院检验科, 湖南 长沙 410005
2. Department of Clinical Laboratory, The First Hospital of Changsha, Changsha 410005, China
碳青霉烯类抗生素是治疗多重耐药肠杆菌科细菌,如肺炎克雷伯菌、大肠埃希菌和肠杆菌属细菌严重感染的关键药物。然而,随着该类药物在临床上的广泛应用,肠杆菌科细菌,尤其是肺炎克雷伯菌对碳青霉烯类药物耐药率不断上升,现已达到或超过20%[1-2]。肺炎克雷伯菌毒力强,所致感染临床症状无明显特异性,一旦对碳青霉烯类耐药,其引起的感染治疗十分困难,病死率极高,已引起全球学者广泛关注。碳青霉烯类抗生素主要包括亚胺培南、美罗培南和厄他培南等。产碳青霉烯酶是肺炎克雷伯菌对碳青霉烯类药物耐药最主要的机制[3],碳青霉烯酶能水解包括碳青霉烯类在内的几乎所有β-内酰胺类抗生素。基于分子特征的不同,目前已知的碳青霉烯酶分别属于Ambler分类法中的A、B及D类。A类和D类为丝氨酸碳青霉烯酶,A类编码基因以KPC、GES、SHV、TEM和CTX-M等多见,D类以OXA多见。B类为金属酶,常见编码基因为IMP、VIM、GIM和NDM等。部分编码碳青霉烯酶的基因可通过质粒等移动性元件在细菌间水平传播,目前国内外报道较多的有KPC-2、KPC-3、IMP-4、NDM-1和OXA-48等基因亚型,可导致局部流行,甚至感染暴发。因此,及时、快速、准确地检测产碳青霉烯酶菌株,对患者的治疗和及时采取相应的感染控制措施,防止耐药菌的播散具有十分重要的意义。美国临床实验室标准化协会(CLSI)以流行病学调查或感染控制为目的,先后推荐改良Hodge试验(MHT)、Carba NP试验(CNPt)及改良碳青霉烯酶灭活试验(mCIM)用于检测碳青霉烯酶。本研究采用三种方法对临床分离的117株肺炎克雷伯菌碳青霉烯酶进行检测,以探讨其临床应用价值,现报告如下。
1 对象与方法 1.1 菌株来源收集某院2016年12月—2017年11月临床分离的117株肺炎克雷伯菌,所有菌株均采用VITEK-2全自动微生物分析系统及K-B法进行药物敏感试验,其中对碳青霉烯类耐药57株,敏感60株。质控菌株大肠埃希菌ATCC 25922购自卫生部临床检验中心,ATCC BAA-1705(碳青霉烯酶阳性)和ATCC BAA-1706(碳青霉烯酶阴性)由北京大学临床药理研究所李耘教授惠赠。
1.2 主要试剂与仪器美罗培南药敏纸片(10 μg)购自英国Oxoid公司,亚胺培南粉剂购自美仑生物,D2000 DNA Marker和引物购自生工生物工程(上海)股份有限公司,XD-685电解质仪购自上海迅达医疗仪器公司,全自动微生物鉴定及药敏分析系统VITEK 2 Compact及革兰阴性细菌药敏卡片购自法国生物梅里埃公司,Technologies ProFlex梯度PCR购自赛默飞世尔科技,JY600E电泳仪购自北京君意东风电泳设备有限公司。
1.3 方法 1.3.1 菌株复苏从冰箱中取出保存菌种恢复至室温,接种血平板,35℃培养18~20 h。
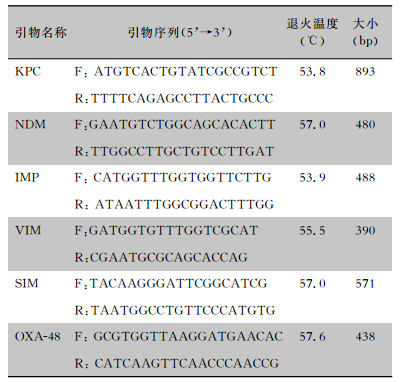
1.3.2 碳青霉烯酶基因检测PCR引物参考相关文献[4-5]设计,序列见表 1。扩增碳青霉烯酶基因包括blaKPC、blaNDM-1、blaIMP、blaVIM、blaSIM和blaOXA-48。阳性对照和阴性对照为前期经测序证实携带或不携带碳青霉烯酶基因的临床菌株。煮沸法提取DNA模板,PCR反应体系为20 μL,包括2×Taq PCR Master Mix 10 μL, 上下游引物各1 μL, DNA模板2 μL, ddH2O 6 μL。PCR扩增反应条件:预变性95℃,5 min,变性95℃,30 s,退火(具体温度详见表 1)30 s,延伸72℃,30 s,共35个循环;最后72℃延伸10 min。扩增产物经1%凝胶电泳(100 V、40 mA)后凝胶成像系统观察结果拍照。阳性扩增产物送华大基因科技股份有限公司测序,序列经BLAST数据库进行对比分析。
| 表 1 碳青霉烯酶基因检测PCR引物序列及产物长度 Table 1 PCR primers sequences and product length of carbapenemase gene |
|
具体操作参照2017年CLSI标准进行[6]。挑取大肠埃希菌ATCC 25922(指示菌)于无菌盐水中配制0.5麦氏单位菌悬液,将菌液1:10稀释后,均匀涂布于MH平板上,待吸收完全,中央贴美罗培南药片。挑取3~5个待测菌株或质控菌株,从离美罗培南药敏纸片5~10 mm处向平板边缘划线,长度20~25 mm,35℃过夜培养。结果判断:(1)增强性生长, 提示产碳青霉烯类酶,结果阳性;(2)无增强性生长, 提示非产碳青霉烯类酶,结果阴性。
1.3.4 CNPt具体操作参照2017年CLSI操作标准进行[6]。分别在微量离心管a和管b中加入100 μL pH 7.4 Tris HCl buffer细菌蛋白提取试剂,挑取1 μL接种环待测菌落或质控菌株接种乳化,漩涡震荡5 s。在管a中加入100 μL pH 7.8的酚红硫酸锌溶液,在管b中加入100 μL pH 7.8含6 mg/mL亚胺培南酚红硫酸锌溶液,混匀,35℃,孵育2 h,观察管中液体颜色的变化。结果判断:(1)对照管a为红色或橘红色,2 h后不变色;(2)管b 2 h后为红色或橘红色(不变色),为阴性;(3)管b 2 h后变为浅橘色、深黄色或黄色,为阳性。
1.3.5 mCIM具体操作参照2017年CLSI操作标准进行[6]。刮取1 μL接种环待测菌落或质控菌株接种至2 mL TSB营养肉汤中乳化,漩涡震荡10~15 s,再放入美罗培南药敏纸片,35℃孵育4 h±15 min。配制0.5麦氏单位大肠埃希菌ATCC 25922菌悬液均匀涂布于MH平板上,待吸收,取出孵育后的美罗培南纸片并贴在此MH平板上,35 ℃孵育18~24 h,观察抑菌圈的大小。结果判断:(1)抑菌环直径6~15 mm或16~18 mm,但抑菌圈内有散在菌落,判为产碳青霉烯酶;(2)抑菌环直径≥19 mm,且抑菌圈内无散在菌落,判为菌株不产碳青霉烯类酶;(3)抑菌环直径16~18 mm或者抑菌环直径≥19 mm,但抑菌圈内有散在菌落为灰区。
2 结果 2.1 碳青霉烯酶耐药基因检测57株耐药菌株中碳青霉烯酶基因阳性40株,包括39株KPC和1株NDM-1,其余17株菌未检出blaIMP、blaVIM、blaSIM和blaOXA-48等碳青霉烯酶基因。60株碳青霉烯敏感菌株基因检测均为阴性。阳性产物测序后,经BLAST软件分析,与目的耐药基因同源性均≥99%。部分阳性结果电泳图见图 1。
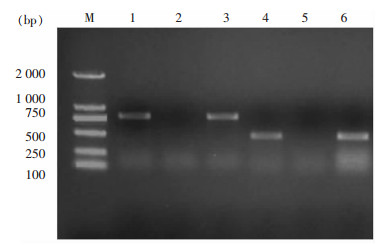 |
| M:DNA Marker; 1:blaKPC阳性对照; 2:blaKPC阴性对照; 4:blaNDM阳性对照; 5:blaNDM阴性对照; 3、6:待测菌株 图 1 碳青霉烯酶基因PCR产物凝胶电泳图 Figure 1 Electrophoresis map of PCR amplification pro-ducts of carbapenemase gene |
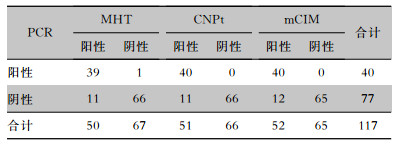
60株碳青霉烯敏感株MHT检测结果全部阴性,57株耐药菌中阳性50株,阳性率87.7%。以耐药基因扩增为金标准,MHT筛查肺炎克雷伯菌是否产碳青霉烯酶的灵敏度和特异度分别为97.5%(39/40)、85.7%(66/77),部分菌株结果见图 2及表 2。
 |
| ATCC 1705:阳性对照;ATCC 1706:阴性对照;1、2:待测菌株结果阳性 图 2 部分菌株MHT试验结果 Figure 2 MHT results of partial strains |
| 表 2 3种方法筛选肺炎克雷伯菌产碳青霉烯酶的结果 Table 2 Results of three methods for screening carbapenemases from K. pneumoniae |
|
60株碳青霉烯敏感株CNPt检测结果全部阴性,57株耐药株中51株阳性,阳性率89.5%。以耐药基因扩增为金标准,CNPt筛查肺炎克雷伯菌是否产碳青霉烯酶的灵敏度和特异度分别为100.0%(40/40)和85.7%(66/77),部分菌株结果见图 3及表 2。
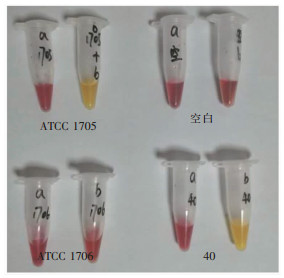 |
| ATCC 1705:阳性对照;ATCC1706:阴性对照;空白:空白对照管;40:待测菌株结果阳性 图 3 CNPt筛选产碳青霉烯酶菌株的结果 Figure 3 Screening result of carbapenemase-producing strains by CNPt |
60株碳青霉烯敏感株mCIM检测结果全部阴性,57株耐药株中52株阳性,阳性率91.2%。mCIM筛查肺炎克雷伯菌是否产碳青霉烯酶的灵敏度和特异度分别为100.0%(40/40)、84.4%(65/77),部分结果见图 4及表 2。
 |
| ATCC 1705:阳性对照;ATCC 1706:阴性对照;1、2:待测菌株结果阳性 图 4 mCIM筛选产碳青霉烯酶菌株的结果 Figure 4 Screening result of carbapenemase-producing strains by mCIM |
自2005年后,国内外[7-8]相继报道耐碳青霉烯肠杆科细菌,且耐药率呈逐年上升趋势。我国CHINET细菌耐药监测结果显示,除克雷伯菌属外多数肠杆菌科细菌对碳青霉烯类耐药率均未超过10.0%,而肺炎克雷伯菌对亚胺培南和美罗培南的耐药率分别达20.9%和24.0%,2017年与2005年相比,上升了近8倍[1]。肺炎克雷伯菌对碳青霉烯酶类药物耐药已十分严重,应引起临床高度重视。由于肺炎克雷伯菌毒力强,引起的感染常较严重,一旦对碳青霉烯类耐药,治疗十分棘手。因此,快速、准确检测肺炎克雷伯菌是否产生碳青霉烯酶具有十分重要的临床意义和感控价值。
本研究中,39株携带KPC基因的菌株,MHT、CNPt及mCIM均为阳性,与报道[9]一致。与基因检测相比,3种筛选试验均存在假阳性,假阳性率分别为22.0%、21.6%和23.1%,经复核试验两次结果相同。肺炎克雷伯菌的耐药机制十分复杂,除碳青霉烯酶外,其他β-内酰胺酶对碳青霉烯类药物也可有不同程度的水解能力。同时,基因检测仅针对目前已知的相关基因,无法覆盖所有可能机制,基因检测可能存在假阴性的情况。5株碳青霉烯耐药菌株,PCR未检测到碳青霉烯酶基因,三种检测结果也均为阴性,究其原因可能是此5株耐药菌株为非碳青霉烯酶机制所致,如高产AmpC和(或)ESBLs、膜孔蛋白的改变等。本研究中3种方法的原理均基于碳青霉烯酶对碳青霉烯类抗生素的水解设计,此5株耐药菌株结果为阴性,与文献[10-11]报道一致。
文献[4,12]报道,MHT检测NDM-1型酶菌株时可出现假阴性。本研究中亦发现1株携带NDM-1耐药基因的菌株(KP10)MHT结果为阴性,而mCIM和CNPt结果均为阳性,说明检测金属酶该试验可能会造成漏检。
研究中碳青霉烯类耐药肠杆菌科细菌CNPt阳性结果均在15 min内出现[9],而本研究51株CNPt阳性中仅有14株耐药株15 min内出现阳性结果,其中1株菌不到5 min溶液即变为深黄色,推测CNPt试验结果可能与该菌产酶量和酶活性强弱有关。文献[13]报道,黏液型菌株CNPt可表现为假阴性。本研究中有3株黏液型肺炎克雷伯菌CNPt 2 h左右仅显橙色,呈弱阳性,而mCIM均为阳性,可能与黏液型菌株释放碳青霉烯酶缓慢或产酶量低有关,说明mCIM对于黏液型肺炎克雷伯菌碳青霉烯酶的筛查能力更强。有研究认为,CNPt可直接检测预处理后的血培养阳性标本中产酶株,甚至在肺炎克雷伯菌MIC值未达到耐药水平时即鉴别是否产酶[14-16]。CNPt检测周期短,2 h即可判断结果。因此,CNPt适用于临床实验室小批量检测产酶株,可为医院感染控制快速提供流行病学信息。需要注意的是,CNPt原理是细菌释放出碳青霉烯酶水解亚胺培南并产酸,pH值下降,酚红指示剂由橘红色变为黄色或橙色判断为阳性结果[17]。因此,反应溶液pH值调节十分关键。在实验中发现,选择半自动电解质仪替代pH精密试纸,将pH值精确调节至7.8,结果颜色变化更加敏感,有利于结果的观察。
本研究发现个别菌株MHT或CNPt试验结果难以判断,但mCIM的阴性和阳性结果十分明确。同时,mCIM仅使用常规药敏纸片,成本低廉,操作简单,结果判断直观明确,但mCIM需要过夜孵育,时间相对较长,适用于临床微生物实验室常规开展。MHT检测金属酶的灵敏度低,假阴性高。随着产金属酶菌株的流行,MHT已不宜作为检测碳青霉烯酶的方法,CLSI 2018年推荐eCIM取代MHT,并联合mCIM用于金属β-内酰胺酶的检测。CNPt结果快速,但需要特殊配制试剂,操作繁琐。可见,MHT、CNPt和mCIM三种筛选耐碳青霉酶的方法各有优缺点。实验室可根据目的及实验条件不同,选择最合适的碳青霉烯酶表型检测方法。
| [1] |
胡付品, 郭燕, 朱德妹, 等. 2017年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2018, 18(3): 241-251. |
| [2] |
徐红云, 刘春林, 陈弟, 等. 2010—2016年耐碳青霉烯类肺炎克雷伯菌及大肠埃希菌临床分布及其耐药特征[J]. 中国感染控制杂志, 2018, 17(8): 688-692. DOI:10.3969/j.issn.1671-9638.2018.08.007 |
| [3] |
Sun Y, Li M, Chen L, et al. Prevalence and molecular characterization of carbapenemase-producing gram-negative bacteria from a university hospital in China[J]. Infect Dis(Lond), 2016, 48(2): 138-146. DOI:10.3109/23744235.2015.1094822 |
| [4] |
豆清娅, 邹明祥, 李春辉, 等. 耐亚胺培南肺炎克雷伯菌的耐药机制研究[J]. 中华医院感染学杂志, 2016, 26(13): 2906-2909. |
| [5] |
解春宝, 喻华, 肖代雯, 等. 一株对3种碳青霉烯类抗菌药物均耐药的肺炎克雷伯菌耐药机制研究[J]. 检验医学, 2014, 29(4): 369-374. DOI:10.3969/j.issn.1673-8640.2014.04.016 |
| [6] |
Clinical and Laboratory Standards Institute. Performance stan-dards for antimicrobial susceptibility testing, twenty-seventh informational supplement[S]. CLSI, 2017, M100-S27.
|
| [7] |
Castanheira M, Farrell SE, Deshpande LM, et al. Prevalence of β-lactamase encoding genes among Enterobacteriaceae bacteremia isolates collected in 26 U.S. hospitals: Report from the SENTRY Antimicrobial Surveillance Program (2010)[J]. Antimicrobial Agents Chemother, 2013, 57(7): 3012-3020. DOI:10.1128/AAC.02252-12 |
| [8] |
Villegas MV, Lolans K, Correa A, et al. First detection of the plasmid-mediated class A carbapenemase KPC-2 in clinical isolates of Klebsiella pneumoniae from South America[J]. Antimicrob Agents Chemother, 2006, 50(8): 2880-2882. DOI:10.1128/AAC.00186-06 |
| [9] |
胡仁静, 严子禾, 韩志君, 等. Carba NP试验及Carba NP-direct试验检测产碳青霉烯酶肠杆菌的临床意义[J]. 临床与病理杂志, 2016, 36(8): 1079-1086. |
| [10] |
Hamzaoui Z, Ocampo-Sosa A, Fernandez Martinez M, et al. Role of association of OmpK35 and OmpK36 alteration and blaESBL and/or blaAmpC genes in conferring carbapenem resistance among non-carbapenemase-producing Klebsiella pneumoniae[J]. Int J Antimicrob Agents, 2018, 52(6): 898-905. DOI:10.1016/j.ijantimicag.2018.03.020 |
| [11] |
黄峰, 许元元. 耐碳青霉烯类肺炎克雷伯菌耐药基因检测及同源性[J]. 中国感染控制杂志, 2018, 17(1): 21-25. DOI:10.3969/j.issn.1671-9638.2018.01.005 |
| [12] |
Yamada K, Kashiwa M, Arai K, et al. Comparison of the modified-Hodge test, Carba NP test, and carbapenem inactivation method as screening methods for carbapenemase-producing Enterobacteriaceae[J]. J Microbiol Methods, 2016, 128: 48-51. DOI:10.1016/j.mimet.2016.06.019 |
| [13] |
Tijet N, Boyd D, Patel SN, et al. Evaluation of the Carba NP test for rapid detection of carbapenemase-producing Enterobacteriaceae and Pseudomonas aeruginosa[J]. Antimicrob Agents Chemother, 2013, 57(9): 4578-4580. DOI:10.1128/AAC.00878-13 |
| [14] |
Srisrattakarn A, Lulitanond A, Wilailuckana C, et al. Modification and evaluation of the Carba NP test by use of paper strip for simple and rapid detection of carbapenemase-producing Enterobacteriaceae[J]. World J Microbiol Biotechnol, 2016, 32(7): 117. DOI:10.1007/s11274-016-2064-x |
| [15] |
Dortet L, Bréchard L, Poirel L, et al. Rapid detection of carbapenemase-producing Enterobacteriaceae from blood cultures[J]. Clin Microbiol Infect, 2014, 20(4): 340-344. DOI:10.1111/1469-0691.12318 |
| [16] |
朱雄, 袁敏, 刘佳, 等. Carba NP碳青霉烯酶检测方法在医院感染监测中的应用[J]. 中华医院感染学杂志, 2014, 24(23): 5721-5724. |
| [17] |
Nordmann P, Poirel L, Dortet L. Rapid detection of carbapene-mase producing Enterobacteriaceae[J]. Emerg Infect Dis, 2012, 18(9): 1503-1507. DOI:10.3201/eid1809.120355 |



