2. 中南大学湘雅医院风湿免疫科, 湖南 长沙 410008
2. Department of Rheumatology and Immunology, Xiangya Hospital, Central South University, Changsha 410008, China
嗜酸性肉芽肿性多血管炎(eosinophilic granulomatosis with polyangiitis, EGPA)是一种外周血及组织中嗜酸性粒细胞增多的累及中小血管的系统性坏死性炎症,其与肉芽肿性多血管炎(granulomatosis with polyangiitis, GPA)、显微镜下多血管炎(microscopic polyangiitis, MPA)一同被归类为抗中性粒细胞胞质抗体(anti-neutrophil cytoplasmic antibody, ANCA)相关性血管炎(ANCA-associated vasculitis, AAV),于1951年由Churg和Strauss首先描述,在1994年的Chapel Hill会议上被正式命名为变异性肉芽肿性血管炎[1-2],在2012年的Chapel Hill会议上又被更名为EGPA[3]。EGPA是一种自身免疫性疾病,在临床上少见,临床表现复杂多样,常以哮喘、嗜酸性粒细胞增多症、坏死性血管外肉芽肿和全身性血管炎等为主要特征,进展至后期病变可累及全身多个组织器官[4]。治疗上则以糖皮质激素和免疫抑制剂为主,近来也有新型治疗方案出现,但尚需临床研究进一步证实[5]。由于EGPA患者临床表现呈高度异质性,容易被误诊及漏诊,且免疫功能紊乱,预后不佳,易合并感染。本研究对中南大学湘雅医院收治住院EGPA患者的临床资料进行回顾性分析,以总结疾病临床病理特征,评估预后及感染情况。
1 对象与方法 1.1 研究对象回顾性分析中南大学湘雅医院2010年1月—2019年4月收治住院确诊EGPA患者的临床资料。共有25例患者符合1990年美国风湿病学会CSS诊断标准[6]:(1)哮喘;(2)嗜酸性粒细胞增多(≥10%或绝对值≥1.5×109/L);(3)单发或多发神经病变;(4)非固定性肺浸润;(5)鼻窦炎;(6)血管外嗜酸性粒细胞浸润。以上6条符合4条可诊断为CSS。
1.2 方法 1.2.1 资料采集收集所有患者发病年龄、性别、发病至确诊时间、临床表现、住院后首次实验室检验资料(血常规、尿常规、血培养、痰培养、血沉、肝肾功能、ANCA、狼疮全套、风湿全套、补体、24 h尿蛋白定量),检查资料(胸片、肺部CT、肌电图、心脏彩超等)、活检病理资料、治疗方案及疗效。
1.2.2 病情评估利用伯明翰血管炎活动性评分(BVAS)[7]进行疾病活动性评估,应用5因子评分(FFS)[8]评估预后:(1)胃肠道受累;(2)心脏受累;(3)血肌酐>150 μmol/L;(4)年龄>65岁;(5)耳鼻喉未受累。根据不良反应评价标准(CTCAE)4.0版[9],依据临床症状、体征、实验室和微生物学及辅助检查综合判断评估感染情况。
1.3 统计学分析应用SPSS 23.0软件进行数据处理。符合正态分布的计量资料采用均数±标准差表示,采用t检验进行比较;不符合正态分布的计量资料采用M(Q1,Q3)表示,采用非参数秩和检验进行比较。计数资料比较采用百分比表示,采用卡方检验(Fisher确切概率法)进行比较。P≤0.05为差异具有统计学意义。
2 结果 2.1 基本资料25例患者中男性18例、女性7例,确诊时平均年龄为(53.6±14.0)岁。从起病至确诊的中位时间为12(2.5,27.7)个月,最长时间达132个月。
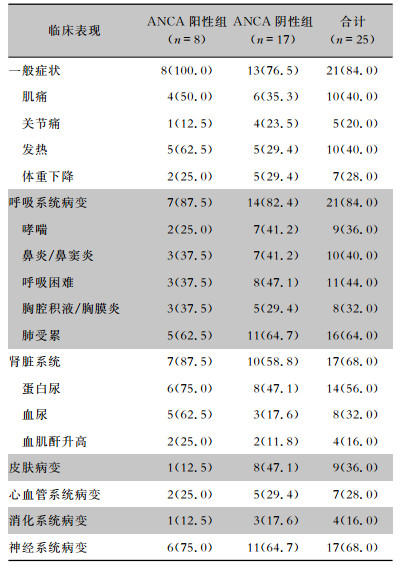
2.2 临床表现EGPA患者全身非特异性症状发生率高(84.0%),以发热和(或)肌肉痛为主。21例(84.0%)患者出现呼吸系统受累,其中肺累及最多见,且有11例患者出现呼吸困难,8例患者有胸腔积液或胸膜炎,另外鼻炎或鼻窦炎患者共有10例,哮喘9例;17例(68.0%)患者肾脏系统受累,其中表现为蛋白尿14例,血尿8例,肾功能不全4例。17例(68.0%)患者神经系统受累,以外周神经病变为主,常表现为肢体麻木;9例(36.0%)患者皮肤受累,以皮疹、紫癜、皮炎为主要表现。7例(28.0%)患者心脏受累,其中有3例出现心包积液,1例表现为心包炎。4例(16.0%)患者消化道受累,表现为缺血性腹痛及血性腹泻。ANCA阳性组与阴性组EGPA患者的临床表现比较,差异均无统计学意义(均P>0.05)。见表 1。
| 表 1 ANCA阳性与ANCA阴性EGPA患者的临床表现[例(%)] Table 1 Clinical manifestations of ANCA-positive and ANCA-negative EGPA patients(No. of cases[%]) |
|
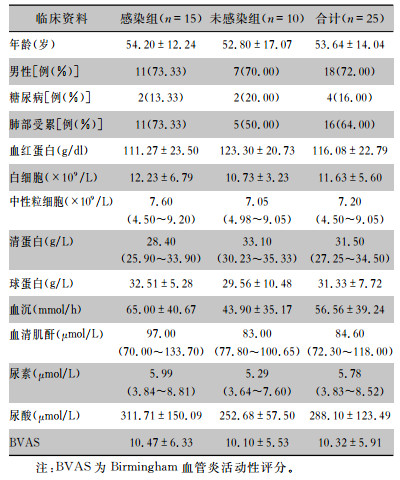
25例EGPA患者有15例发生感染,以肺部受累最为常见(11例),另外还有急性分泌性中耳炎、金黄色葡萄球菌血流感染合并感染相关性急性间质肾炎、心包炎等其他部位受累的感染情况。5例肺部感染患者痰培养检出病原体,其中2例为假丝酵母菌感染,其余3例分别为肺炎克雷伯菌、大肠埃希菌及金黄色葡萄球菌感染。与未感染组患者相比,感染组患者确诊EGPA时血浆球蛋白水平较高,差异有统计学意义(P<0.05);两组患者的其他临床资料比较,差异均无统计学意义(均P>0.05)。见表 2。
| 表 2 感染组与未感染组EGPA患者临床资料比较 Table 2 Comparison of clinical data of EGPA patients between infection group and non-infection group |
|
8例(32.0%)患者ANCA阳性,5例患者核周型ANCA(p-ANCA)、髓过氧化物酶(myeloperoxidase, MPO)-ANCA均阳性,2例患者胞浆型ANCA(c-ANCA)和丝氨酸蛋白酶-3(proteinase-3, PR3)-ANCA均阳性,1例患者仅p-ANCA阳性。4例患者抗核抗体阳性,15例患者嗜酸性粒细胞比例增高,15例患者中性粒细胞分类计数升高,18例患者ESR增快,19例患者CRP增高,15例患者白细胞计数升高,5例患者IgG升高,20例患者清蛋白降低,4例患者IgE升高。
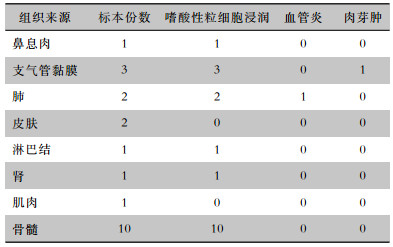
2.4.2 辅助检查及病理检查11例患者行肌电图检查,10例表现异常,且以四肢周围神经病变为主,多为双下肢神经病变。4例患者行肺功能检查,限制性和阻塞性通气功能障碍各1例,支气管扩张试验阳性2例,支气管激发试验阳性1例。25例患者中共有15例行穿刺活检,1例3个部位活检,4例2个部位活检,病理结果见表 3,病理来源于支气管黏膜、肺、骨髓、皮肤、淋巴结、鼻息肉、肾和肌肉组织。18例病理表现为血管外嗜酸性粒细胞浸润,1例血管炎,1例有肉芽肿样病理学改变。嗜酸性粒细胞浸润合并血管炎和嗜酸性粒细胞浸润合并肉芽肿各1例。
| 表 3 15例EGPA患者组织病理学检查结果(份) Table 3 Histopathological examination results of 15 EGPA patients(No. of specimens) |
|
根据BVAS,有6例患者评分>15分(范围:16~25分),处于活动期。8例FFS=0分,7例FFS=1分,9例FFS=2分,1例FFS=3分。
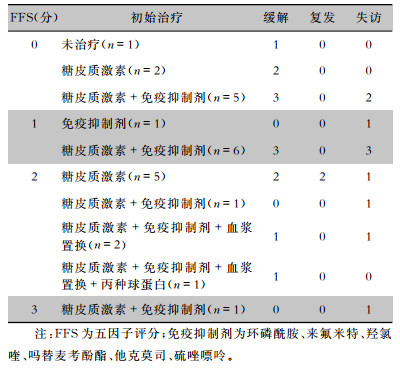
2.6 治疗与预后25例EGPA患者中1例未接受免疫抑制剂治疗,1例患者接受单纯免疫抑制剂治疗,7例患者接受单纯糖皮质激素治疗,16例(64.0%)患者接受糖皮质激素联合免疫抑制剂治疗,其中3例患者同时行血浆置换治疗,1例患者同时予以丙种球蛋白冲击治疗。随访过程中有10例患者失访,余15例患者中位随访时间为35(9~70.5)个月,截至2019年7月患者均存活,2例患者因病情反复多次住院治疗。13例患者获得缓解,6例(24.0%)仍有哮喘症状,12例(48.0%)仍需口服糖皮质激素治疗。见表 4。
| 表 4 25例EGPA患者的预后评价及治疗转归 Table 4 Prognosis and treatment outcome of 25 EGPA patients |
|
EGPA是AAV中最罕见的一种疾病。国外文献报道年发病率仅为0.9例/百万~2.4例/百万,患病率为10.7例/百万~17.8例/百万[10],发病年龄4~74岁,高峰年龄38~54岁[11-13]。本研究中,25例EGPA患者平均年龄为53.6岁,与文献报道一致。
根据1990年ACR标准,外周血嗜酸性粒细胞分类计数>10%是EGPA诊断依据之一,90%EGPA患者外周血嗜酸性粒细胞增多,但是服用糖皮质激素的患者嗜酸性粒细胞分类计数可不增高,研究[14]报道EGPA患者C反应蛋白、血沉也可升高,且与疾病活动性相关。30%~40%的EGPA患者免疫荧光检测ANCA为阳性[15],主要为p-ANCA,几乎所有的p-ANCA均为MPO-ANCA;只有少数患者c-ANCA阳性[16]。本研究中60.0%的患者外周血嗜酸性粒细胞分类计数升高,约70%的患者血沉、C反应蛋白升高,ANCA阳性率为32.0%,以p-ANCA为主,与既往研究报道一致。另外,本研究发现60.0%的患者白细胞、中性粒细胞升高,可能与炎症反应和感染相关,80.0%的患者清蛋白降低,则可能与肾脏受累以及血管炎的高炎症反应相关,需进一步研究论证。
EGPA患者的典型病理特征为嗜酸性粒细胞浸润、坏死性血管炎和血管外坏死性肉芽肿,但很少同时出现在同一病例中[17],一般血管外肉芽肿的活检组织检出率较低[18-19],本研究病理检查结果多以血管外嗜酸性粒细胞浸润为主,血管炎及肉芽肿少见。其病理阳性率受多种因素影响:(1)血管炎临床分为三个阶段,病理特征可随疾病不同阶段而改变[20]。(2)活检之前已经使用了糖皮质激素或免疫抑制剂治疗。(3)由于活检标本过小或者活检部位差异[21-22]。因此在进行病理诊断时,由于这3种病理改变往往不在同一部位出现,或典型血管炎可能仅表现在一个器官系统,对临床拟诊为EGPA的患者,可以多部位和多次取活体组织进行病理组织学检查。若活检病理无典型血管炎表现时,依据1990年ACR标准将其诊断为EGPA仍存很大地争议,特别需注意与其他疾病相互鉴别,也需要更多的研究对EGPA的诊断标准进行优化[23]。
EGPA的临床表现与其他AAVs显著不同,EGPA主要以哮喘及外周血和(或)组织嗜酸性粒细胞增多为特征,而MPA、GPA分别以急进性肾小球肾炎、上呼吸道受累和肺泡出血为主要特征。EGPA首发症状以呼吸道受累最为常见,表现为呼吸道过敏反应,如过敏性鼻炎、哮喘等,过敏性鼻炎发生时常伴鼻窦炎及鼻息肉,哮喘通常在出现血管炎前出现,前驱期较长[24-25]。本研究25例EGPA患者中36.0%的患者出现哮喘,40.0%的患者出现鼻部症状,提示在临床诊断中要注意早期EGPA患者的鼻部症状以及哮喘病史,怀疑EGPA的患者可行鼻窦CT检查,并且重视外周血嗜酸性粒细胞明显增多或肺部影像检查发现浸润性阴影的患者,为降低漏诊率,必要时可行肺部HRCT检查[6, 18-26]。
几乎所有EGPA患者都有发热、肌痛、关节痛等全身症状,随着病情进展也可累及多个脏器,既往研究以神经系统和鼻窦最为常见,神经系统受累约占70%,多表现为周围神经病变,如多发性单神经炎或感觉运动混合性外周神经病变[27]。肺部受累也是常见表现之一,主要为肺内浸润性病变,临床可表现为咳嗽、呼吸困难、胸痛和胸腔积液等,影像学可表现为游走性或一过性浸润影,是EGPA的特征性影像学表现之一[28]。70%的患者可出现皮肤受累,是血管炎期的主要表现,常表现为紫癜、皮下结节、丘疹等[4, 6]。胃肠道受累相对少见,可出现腹痛、腹泻、消化道出血等症状[29]。心脏受累也较少发生,但与其他受累器官相比预后较差,死亡风险更高[30]。肾脏累及相对于其他AAVs少见,在EGPA中约占1/3,累及肾脏主要表现为镜下血尿、蛋白尿,也有肾功能不全[19]。本研究中,84.0%的患者有全身症状,64.0%的患者肺部受累,神经系统受累及肾脏受累占比均为68.0%,同时也有皮肤(36.0%)、心脏(28.0%)和胃肠道(16.0%)累及。
ANCA是血管炎的重要生物标志物,研究表明随ANCA状态不同,EGPA患者临床表现也有所差异[22]。ANCA阳性患者肾小球肾炎、肺泡出血和周围神经病变多见,心脏和肺部受累在ANCA阴性患者中更为常见[31]。Cottin等[32]回顾性分析157例EGPA患者发现,ANCA阳性患者有更多的全身症状和肾脏累及表现,ANCA阴性患者更容易发生心肌病变。Comarmond等[19]回顾性分析348例EGPA患者的临床资料,发现ANCA阳性患者耳鼻喉部症状、周围神经病变和(或)肾脏受累明显多于ANCA阴性患者,但心脏症状较少。本研究进行两组间比较,差异无统计学意义,考虑为样本量较少所致,但结果显示ANCA阳性患者更易出现全身症状和肾脏累及。
EGPA患者的治疗通常根据五因子评分评估后制定,FFS=0分:EGPA患者可使用糖皮质激素控制症状;FFS≥1分:建议糖皮质激素和免疫抑制剂联合治疗[8, 31]。糖皮质激素是治疗EGPA的基础,在治疗重症EGPA患者时,使用糖皮质激素联合免疫抑制剂治疗,通常选用环磷酰胺。EGPA患者诱导缓解治疗选用糖皮质激素和(或)免疫抑制剂,通常在3~6个月达到缓解后再使用硫唑嘌呤或甲氨喋呤进行维持治疗[33]。而对于出现严重的肾功能不全以及肺泡出血的血管炎时,血浆置换可能短期有效[34-35],虽然很少用到免疫球蛋白,也有研究[36]表明静脉注射免疫球蛋白可有效诱导血管炎缓解或逆转其复发。到目前为止,除传统的免疫抑制药物外,也有各种临床试验研究新药作为诱导和维持治疗方法。如作用于B细胞的利妥昔单抗,结合游离IL-5的美波利珠单抗,针对IgE Fc片段的奥马珠单抗等[10]。
EGPA预后较好,发病后5年和10年的累积生存率分别为88%~97%和78%~89%[37-38]。但感染是AAV治疗中的一个主要问题,也是最常见的死亡原因,特别是在营养不良或使用免疫抑制的患者中[39-40]。本研究发现25例患者中有75.0%的患者发生感染,以肺部受累常见,Carcia-Vives等[41]报道的137例AAV患者中,共发生300例次感染,50%患者死于感染,EGPA患者共纳入29例,有8例死于感染。Yang等[42]报道的248例AAV患者中(EGPA患者8例),感染患者87例,共发生103例次严重感染,感染相关病死率为11.7%。McGregor等[43]对489例AAV患者随访2.8年(中位数),第1、2、5年累积感染率分别为51%、58%和65%,重度感染率分别为22%、23%和26%,增加了全因死亡的风险。本研究发现EGPA患者发生感染的病原体以细菌多见,与既往文献[44]报道类似。吸烟、糖尿病、血肌酐升高、免疫抑制剂治疗等都是发生感染的危险因素;严重肾脏损伤或合并有全身基础疾病患者会增加感染风险,包括直接损伤免疫功能,或需要更强烈的免疫抑制剂方案,以及持续性活动性疾病患者需要更长时间的治疗,都与较高的感染率有关[41-43, 45]。提示EGPA患者在治疗过程中要高度警惕各种感染的发生,注意患者护理,加强营养,合理调整免疫抑制剂及适时加用抗菌药物治疗。
综上所述,EGPA患者临床表现多样,容易被漏诊、误诊。EGPA患者治疗过程中感染发生率高,病变部位以肺部最为常见,病原体以细菌为主。
| [1] |
Churg J, Strauss L. Allergic granulomatosis, allergic angiitis, and periarteritis nodosa[J]. Am J Pathol, 1951, 27(2): 277-301. |
| [2] |
Jennette JC, Falk RJ, Andrassy K, et al. Nomenclature of systemic vasculitides. Proposal of an international consensus conference[J]. Arthritis Rheum, 1994, 37(2): 187-192. DOI:10.1002/art.1780370206 |
| [3] |
Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised international Chapel Hill consensus conference nomenclature of vasculitides[J]. Arthritis Rheum, 2013, 65(1): 1-11. DOI:10.1002/art.37715 |
| [4] |
Greco A, Rizzo MI, De Virgilio A, et al. Churg-Strauss syndrome[J]. Autoimmun Rev, 2015, 14(4): 341-348. DOI:10.1016/j.autrev.2014.12.004 |
| [5] |
Pagnoux C, Mendel A. Treatment of systemic necrotizing vasculitides:recent advances and important clinical considerations[J]. Expert Rev Clin Immunol, 2019, 15(9): 939-949. DOI:10.1080/1744666X.2019.1656527 |
| [6] |
Masi AT, Hunder GG, Lie JT, et al. The American College of Rheumatology 1990 criteria for the classification of Churg-Strauss syndrome (allergic granulomatosis and angiitis)[J]. Arthritis Rheum, 1990, 33(8): 1094-1100. |
| [7] |
Dolezalova P, Price-Kuehne FE, Özen S, et al. Disease activity assessment in childhood vasculitis:development and prelimi-nary validation of the paediatric vasculitis activity score (PVAS)[J]. Ann Rheum Dis, 2013, 72(10): 1628-1633. DOI:10.1136/annrheumdis-2012-202111 |
| [8] |
Guillevin L, Pagnoux C, Seror R, et al. The five-factor score revisited:assessment of prognoses of systemic necroti-zing vasculitides based on the French Vasculitis Study Group (FVSG) cohort[J]. Medicine (Baltimore), 2011, 90(1): 19-27. DOI:10.1097/MD.0b013e318205a4c6 |
| [9] |
National Cancer Institute Division of Cancaer Treatment & Diagnosis. Common terminology criteria for adverse events(CTCAE) v4.0[EB/OL]. (2020-03)[2020-03-20]. https://ctep.cancer.gov/protocoldevelopment/electronic_applications/ctc.htm#ctc_40.
|
| [10] |
Furuta S, Iwamoto T, Nakajima H. Update on eosinophilic granulomatosis with polyangiitis[J]. Allergol Int, 2019, 68(4): 430-436. DOI:10.1016/j.alit.2019.06.004 |
| [11] |
Abril A, Calamia KT, Cohen MD. The Churg Strauss syndrome (allergic granulomatous angiitis):review and update[J]. Semin Arthritis Rheum, 2003, 33(2): 106-114. |
| [12] |
Kahn JE, Blétry O, Guillevin L. Hypereosinophilic syndromes[J]. Best Pract Res Clin Rheumatol, 2008, 22(5): 863-882. DOI:10.1016/j.berh.2008.09.010 |
| [13] |
Sinico RA, Bottero P. Churg-Strauss angiitis[J]. Best Pract Res Clin Rheumatol, 2009, 23(3): 355-366. DOI:10.1016/j.berh.2009.02.004 |
| [14] |
Guillevin L, Lhote F, Gayraud M, et al. Prognostic factors in polyarteritis nodosa and Churg-Strauss syndrome. A prospective study in 342 patients[J]. Medicine, 1996, 75(1): 17-28. DOI:10.1097/00005792-199601000-00003 |
| [15] |
Sinico RA, Di Toma L, Maggiore U, et al. Prevalence and clinical significance of antineutrophil cytoplasmic antibodies in Churg-Strauss syndrome[J]. Arthritis Rheum, 2005, 52(9): 2926-2935. DOI:10.1002/art.21250 |
| [16] |
张立春, 高峰. 嗜酸性肉芽肿性多血管炎186例临床荟萃分析[J]. 中国呼吸与危重监护杂志, 2017, 16(5): 505-508. |
| [17] |
Mouthon L, Dunogue B, Guillevin L. Diagnosis and classification of eosinophilic granulomatosis with polyangiitis (formerly named Churg-Strauss syndrome)[J]. J Autoimmun, 2014, 48-49: 99-103. DOI:10.1016/j.jaut.2014.01.018 |
| [18] |
Lanham JG, Elkon KB, Pusey CD, et al. Systemic vasculitis with asthma and eosinophilia:a clinical approach to the Churg-Strauss syndrome[J]. Medicine (Baltimore), 1984, 63(2): 65-81. DOI:10.1097/00005792-198403000-00001 |
| [19] |
Comarmond C, Pagnoux C, Khellaf M, et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss):clinical characteristics and long-term followup of the 383 patients enrolled in the French Vasculitis Study Group cohort[J]. Arthritis Rheum, 2013, 65(1): 270-281. DOI:10.1002/art.37721 |
| [20] |
田新平. 嗜酸性粒细胞肉芽肿性血管炎:一个逐渐受到重视的疾病[J]. 中华临床免疫和变态反应杂志, 2017, 11(3): 199-200. |
| [21] |
Mahr A, Moosig F, Neumann T, et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss):evolutions in classification, etiopathogenesis, assessment and management[J]. Curr Opin Rheumatol, 2014, 26(1): 16-23. |
| [22] |
李杰, 张黎明, 赵雯, 等. 嗜酸性肉芽肿性血管炎43例临床分析[J]. 中华医学杂志, 2016, 96(10): 787-791. |
| [23] |
Cordier JF, Cottin V, Guillevin L, et al. L5. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss)[J]. Presse Med, 2013, 42(4 Pt 2): 507-510. |
| [24] |
Noth I, Strek ME, Leff AR. Churg-Strauss syndrome[J]. Lancet, 2003, 361(9357): 587-594. DOI:10.1016/S0140-6736(03)12518-4 |
| [25] |
Seccia V, Baldini C, Latorre M, et al. Focus on the involvement of the nose and paranasal sinuses in eosinophilic granulomatosis with polyangiitis (Churg-Strauss syndrome):nasal cytology reveals infiltration of eosinophils as a very common feature[J]. Int Arch Allergy Immunol, 2018, 175(1-2): 61-69. DOI:10.1159/000484602 |
| [26] |
张梦圆, 林江涛. 嗜酸性肉芽肿性多血管炎30例临床分析[J]. 中华医学杂志, 2019, 99(16): 1216-1220. |
| [27] |
Titlić M, Kodzoman K, Loncar D. Neurologic manifestations of hypereosinophilic syndrome-review of the literature[J]. Acta Clin Croat, 2012, 51(1): 65-69. |
| [28] |
Feng RE, Xu WB, Shi JH, et al. Pathological and high resolution CT findings in Churg-Strauss syndrome[J]. Chin Med Sci J, 2011, 26(1): 1-8. |
| [29] |
Sironen RK, Seppä A, Kosma VM, et al. Churg-Strauss syndrome manifested by appendicitis, cholecystitis and superficial micronodular liver lesions-an unusual clinicopathological presentation[J]. J Clin Pathol, 2010, 63(9): 848-850. DOI:10.1136/jcp.2010.078279 |
| [30] |
Neumann T, Manger B, Schmid M, et al. Cardiac involvement in Churg-Strauss syndrome:impact of endomyocarditis[J]. Medicine (Baltimore), 2009, 88(4): 236-243. DOI:10.1097/MD.0b013e3181af35a5 |
| [31] |
Ribi C, Cohen P, Pagnoux C, et al. Treatment of Churg-Strauss syndrome without poor-prognosis factors:a multicenter, prospective, randomized, open-label study of seventy-two patients[J]. Arthritis Rheum, 2008, 58(2): 586-594. DOI:10.1002/art.23198 |
| [32] |
Cottin V, Bel E, Bottero P, et al. Revisiting the systemic vasculitis in eosinophilic granulomatosis with polyangiitis (Churg-Strauss):a study of 157 patients by the Groupe d'Etudes et de Recherche sur les Maladies Orphelines Pulmonaires and the European Respiratory Society Taskforce on eosinophilic granulomatosis with polyangiitis (Churg-Strauss)[J]. Autoimmun Rev, 2017, 16(1): 1-9. DOI:10.1016/j.autrev.2016.09.018 |
| [33] |
Raffray L, Guillevin L. Treatment of eosinophilic granulomatosis with polyangiitis:a review[J]. Drugs, 2018, 78(8): 809-821. DOI:10.1007/s40265-018-0920-8 |
| [34] |
Jayne DR, Gaskin G, Rasmussen N, et al. Randomized trial of plasma exchange or high-dosage methylprednisolone as adjunctive therapy for severe renal vasculitis[J]. J Am Soc Nephrol, 2007, 18(7): 2180-2188. DOI:10.1681/ASN.2007010090 |
| [35] |
Walsh M, Merkel PA, Peh CA, et al. Plasma exchange and glucocorticoids in severe ANCA-associated vasculitis[J]. N Engl J Med, 2020, 382(7): 622-631. DOI:10.1056/NEJMoa1803537 |
| [36] |
Crickx E, Machelart I, Lazaro E, et al. Intravenous immunoglobulin as an immunomodulating agent in antineutrophil cytoplasmic antibody-associated vasculitides:a French nationwide study of ninety-two patients[J]. Arthritis Rheumatol, 2016, 68(3): 702-712. DOI:10.1002/art.39472 |
| [37] |
Moosig F, Bremer JP, Hellmich B, et al. A vasculitis centre based management strategy leads to improved outcome in eosinophilic granulomatosis and polyangiitis (Churg-Strauss, EGPA):monocentric experiences in 150 patients[J]. Ann Rheum Dis, 2013, 72(6): 1011-1017. DOI:10.1136/annrheumdis-2012-201531 |
| [38] |
Tsurikisawa N, Oshikata C, Kinoshita A, et al. Longterm prognosis of 121 patients with eosinophilic granulomatosis with polyangiitis in Japan[J]. J Rheumatol, 2017, 44(8): 1206-1215. DOI:10.3899/jrheum.161436 |
| [39] |
Charlier C, Henegar C, Launay O, et al. Risk factors for major infections in Wegener granulomatosis:analysis of 113 patients[J]. Ann Rheum Dis, 2009, 68(5): 658-663. DOI:10.1136/ard.2008.088302 |
| [40] |
Gayraud M, Guillevin L, le Toumelin P, et al. Long-term followup of polyarteritis nodosa, microscopic polyangiitis, and Churg-Strauss syndrome:analysis of four prospective trials including 278 patients[J]. Arthritis Rheum, 2001, 44(3): 666-675. DOI:10.1002/1529-0131(200103)44:3<666::AID-ANR116>3.0.CO;2-A |
| [41] |
Garcia-Vives E, Segarra-Medrano A, Martinez-Valle F, et al. Prevalence and risk factors for major infections in patients with antineutrophil cytoplasmic antibody-associated vasculitis:influence on the disease outcome[J]. J Rheumatol, 2020, 47(3): 407-414. DOI:10.3899/jrheum.190065 |
| [42] |
Yang L, Xie H, Liu Z, et al. Risk factors for infectious complications of ANCA-associated vasculitis:a cohort study[J]. BMC Nephrol, 2018, 19(1): 138. DOI:10.1186/s12882-018-0933-2 |
| [43] |
McGregor JG, Negrete-Lopez R, Poulton CJ, et al. Adverse events and infectious burden, microbes and temporal outline from immunosuppressive therapy in antineutrophil cytoplasmic antibody-associated vasculitis with native renal function[J]. Nephrol Dial Transplant, 2015, 30(Suppl 1): i171-i181. |
| [44] |
杨柳, 谢红浪, 刘正钊, 等. 抗中性粒细胞胞质抗体相关血管炎合并感染患者的临床特征[J]. 肾脏病与透析肾移植杂志, 2015, 24(4): 331-336. |
| [45] |
Thomas K, Vassilopoulos D. Infections and vasculitis[J]. Curr Opin Rheumatol, 2017, 29(1): 17-23. |



