2. 辽宁省疾病预防控制中心, 辽宁 沈阳 110001;
3. 大连市疾病预防控制中心, 辽宁 大连 116021
2. Liaoning Provincial Center for Disease Control and Prevention, Shenyang 110001, China;
3. Dalian Center for Disease Control and Prevention, Dalian 116021, China
发热伴血小板减少综合征(sever fever with thrombocytopenia syndrome,SFTS)是近年来的新发感染病,2009年首次出现在湖北、河南、安徽、辽宁、江苏等地。患者主要表现为发热、乏力、肌痛, 以及消化道症状等同时伴有血小板的严重降低。2010年我国首次分离出该病毒毒株并命名为“发热伴血小板减少综合征病毒(SFTSV)”[1],2018年国际病毒学委员会将该病毒纳入布尼亚病毒目白纤病毒科班阳病毒属[2-3]。2012年和2013年在韩国、日本分别报道了该病毒[4-5]。美国出现与该病毒相关的heartland病毒[6],2019年越南在回顾性病例研究中证实当地存在SFTSV[7]。SFTSV目前在全球范围内广泛传播,截至2018年我国在25个省份报道了该病例,共报道病例11 995例,实验室确诊病例7 721例,病死率达10.5%[8]。SFTS主要的传播途径是蜱虫叮咬,但是已证实直接接触患者血液、体液也可以人人传播[9]。辽宁省作为最早出现该疾病的几个省份之一,确诊病例主要集中在辽宁东部的丹东市,前期工作中我们对辽宁东部地区的病例进行了系统的总结分析[10-11]。近年来辽宁东部地区SFTS发病率逐渐降低,但辽宁南部地区确诊病例却逐渐增多,尚缺乏辽宁南部地区病例特征、预后和预后影响因素的分析。本研究将2018—2020年辽宁南部地区大连市确诊的SFTS病例作为研究对象,分析其临床特征、预后及其影响因素,为提高危重患者的治愈率提供指导。
1 对象与方法 1.1 临床病例收集2018年1月—2020年7月大连市疾病预防控制中心确诊的SFTS患者112例。所有病例均是根据《发热伴血小板减少综合征防治指南》[12]进行诊断,所有病例血清检测SFTSV核酸均为阳性(均采用荧光PCR技术进行鉴定,试剂盒采用中山生物生产新布尼亚病毒核酸检测试剂盒)。本研究已通过中国医科大学附属第一医院伦理委员会审批。
1.2 纳入指标在本研究中,纳入指标包括患者年龄、发病到入院间隔、住院时间、感染途径、临床特征以及实验室检查结果等。
1.3 统计分析应用SPSS 21.0软件进行数据分析,满足正态分布的变量,采用独立样本t检验,偏态分布的变量采用四分位数表示,组间比较通过非参数检验。计数资料采用例数和百分比表示,采用χ2检验进行组间比较,logistic回归分析判断与患者死亡相关危险因素。以P≤0.05为差异具有统计学意义。
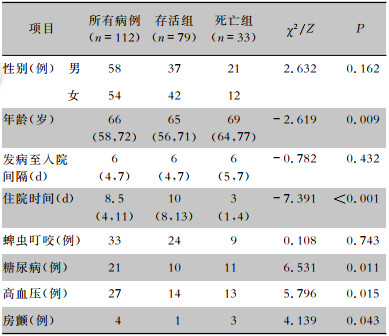
2 结果 2.1 流行病学及患者基本信息本研究共纳入112例患者,男性58例,女性54例。死亡病例33例,病死率达29.5%。患者年龄分布在8~89岁,其中≥60岁的患者78例(69.6%)。所有患者发病时间分布在5—10月,以6~8月份较为集中,共81例患者(72.3%);患者职业以农民居多,共91例(81.3%);均为散发病例,其中33例有明确的蜱虫叮咬史,3例患者接触过因该疾病死亡患者的体液或者血液后而感染。其他患者虽无明确的蜱虫叮咬史,但均有野外工作史。77例(68.8%)患者合并有其他疾病,其中合并高血压患者27例,合并糖尿病患者21例,合并房颤患者4例,合并支气管炎患者11例,1例患者合并丙型病毒炎肝炎,1例患者合并乙型病毒性肝炎。死亡组患者合并糖尿病、高血压、房颤的比例高于存活组,两者之间差异均有统计学意义(均P < 0.05),见表 1。
| 表 1 SFTS患者存活组与死亡组基本资料比较 Table 1 Comparison of basic data between SFTS patients in survival group and death group |
|
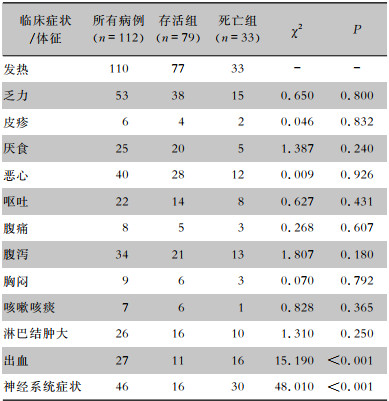
患者入院时主要表现为发热,其次是乏力、恶心、腹泻、呕吐、厌食等消化道症状以及淋巴结肿大,部分患者出现皮疹、腹痛、咳嗽咳痰表现。严重患者出现神经系统症状和出血症状,神经系统症状主要表现是舌颤、反应迟缓、表情淡漠,严重者出现意识障碍。出血主要表现为瘀点、瘀斑、牙龈出血、消化道出血等。存活组与死亡组两组患者在入院时出现神经系统症状和出血比较,差异具有统计学意义(P < 0.05)。见表 2。
| 表 2 SFTS患者存活组与死亡组临床症状比较(例) Table 2 Comparison of clinical symptoms between SFTS patients in survival group and death group (No. of cases) |
|
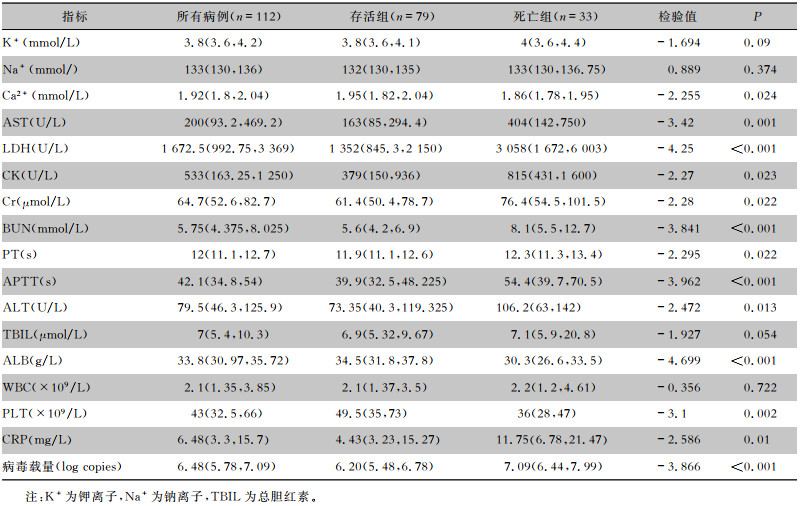
SFTS患者往往会出现白细胞(WBC)和血小板(PLT)的降低。分析SFTS患者入院时的实验室检测结果显示,存活组患者和死亡组患者均出现了血小板的降低,同时可能伴有肝酶、心肌酶的升高,肾功能、凝血等指标的升高。存活组和死亡组患者实验室检测结果比较,钙离子(Ca2+)、门冬氨酸氨基转移酶(AST)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、肌酐(Cr)、尿素氮(BUN)、凝血酶原时间(PT)、凝血酶原活动度(APTT)、丙氨酸氨基转移酶(ALT)、血清清蛋白(ALB)、PLT、C反应蛋白(CRP)、病毒载量各组比较,差异均具有统计学意义(均P < 0.05)。见表 3。
| 表 3 SFTS患者存活组与死亡组实验室检测结果比较 Table 3 Comparison of laboratory detection results between SFTS patients in survival group and death group |
|
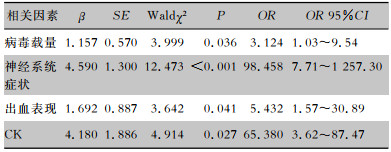
单因素分析共纳入17个实验室指标和13个临床特征评估与存活组、死亡组之间的关系,结果表明,存活组与死亡组患者在年龄、基础疾病、住院时间,以及入院时合并神经系统症状或者出血表现,Ca2+、ALT、AST、LDH、CK、Cr、BUN、PT、APTT、ALB、PLT、CRP、病毒载量水平之间存在差异(均P < 0.05)。将单因素分析中P < 0.05的因素纳入logistic分析中,结果病毒载量水平、早期出现神经系统症状、出血表现、CK>170 U/L可作为患者预后的影响因素。见表 4。
| 表 4 SFTS患者预后相关因素logistic分析结果 Table 4 Logistic analysis on prognostic factors in SFTS patients |
|
SFTS属于新发感染病,无特异性较高的临床症状和实验室指标,早期确诊困难,需要与其他蜱传疾病相鉴别,该疾病目前尚无早期的诊断手段和明确的治疗方案,早期识别,早期对症治疗是降低病死率的有效手段。据报道在2009年发现该疾病,初始病死率高达30%[1],我国平均病死率为10.5%[8]。辽宁省是SFTS发病率较高的省份,近年来确诊病例不断增加。前期研究发现,辽宁东部地区SFTS病死率已经从发病初的12.1%降至3.2%[10],但目前辽南大连地区病死率仍然高达29.5%。前期研究[10]对辽宁东部地区患者的临床特征以及预后相关因素进行分析,本研究结果表明两地病例临床特征以及预后影响因素无明显差异。
SFTS病例多分布在4—10月,7、8月为高发月份,农民和丘陵、山地工作者属于高发人群,因其工作环境更易接触到蜱虫,感染的概率更大。SFTS主要的传播途径是蜱虫叮咬,接触患者的体液或者血液也可能引起人人传播。研究[13]表明,感染途径不同可能导致患者不同的结局,通过接触患者体液血液而感染的病例往往症状较轻,预后较好。本研究发生人际传播的3例感染者,其中1例患者死亡。在人际传播引起的聚集性发病研究中,并非所有接触患者血液体液的人都会感染,3例感染患者中1例死亡,其余两例存活,人际传播可能与遗传易感性有关[14]。在本研究中,蜱虫叮咬在危重组与普通组之间的差异不具备统计学意义。多项研究[15-16]表明,年龄因素可以作为SFTS患者死亡的独立危险因素,本研究结果与此一致,可能是因为高年龄组患者的免疫力较差,在SFTSV感染动物试验中发现免疫力正常的大鼠对SFTSV不敏感,但是基因敲除免疫缺陷的鼠会出现严重症状,甚至死亡。
SFTSV具有泛噬性,会对人体的各个器官、细胞产生损伤,引起相应的临床症状和实验室指标的升高。SFTS患者临床症状表现为发热、乏力、厌食、恶心、呕吐等消化道症状,以及肌肉酸痛、咳嗽、咳痰、淋巴结肿大等表现,严重患者会出现瘀血、瘀斑、消化道出血等出血症状,或者舌体、肢体颤动、神志不清等神经系统症状,神经系统症状和出血表现可以作为判断患者预后不良的预测指标[10, 17]。本研究中33例死亡患者,入院时30例患者已经出现神经系统症状,16例患者出现出血症状。logistic分析结果显示,早期神经系统表现和出血表现可作为影响患者预后的因素。当患者合并基础疾病时,会增加患者病死率。本研究高血压、糖尿病、房颤三个指标,存活组与死亡组患者比较,差异均具有统计学意义。研究显示,当患者合并慢性阻塞性肺疾病、心血管疾病时患者的死亡风险升高[18]。
研究[19-20]显示,SFTS实验室指标的变化可用来预测患者疾病进展,患者预后。SFTSV可以侵袭患者各个器官,在本研究中患者会出现不同程度的肝、肾、心肌、血液受损的症状,出现ALT、AST升高,ALB的降低反映肝脏受损的情况。研究发现,患者以肝酶升高为主,较少出现胆红素的异常,反映以肝细胞受损为主。死亡组患者出现明显的凝血功能异常,PT时间延长,APTT降低,存活组与死亡组患者之间差异具有统计学意义。BUN、Cr的变化反映肾受损严重程度,死亡组患者较存活组患者升高明显,而在存活组患者中大多数患者的BUN水平正常,肌酐轻微升高。本研究中,AST/ALT的水平升高,提示AST水平的升高不仅是肝功能受损引起,还包括心肌功能的受损。LDH、CK升高明显,CK可作为预测患者预后的指标。研究[21-22]显示,LDH水平升高可作为SFTS患者死亡的独立危险因素。CRP水平反映患者细菌病毒感染程度,死亡组患者出现明显升高。SFTS患者往往伴有不同程度的离子紊乱,主要表现为低钾血症、低钠血症、低钙血症,K+和Na+降低两组间差异并不具有统计学意义,Ca2+降低两组间差异存在统计学意义。
病毒载量的变化对于预测患者的疾病进展具有一定的价值,持续的病毒载量检测可以用于判断患者所处疾病阶段以及预后。在本研究中,存活组与死亡组患者入院时病毒载量具有明显的差异,且可作为患者预后的预测指标。研究[21]表明,在疾病的不同阶段病毒载量有变化。发热期存活组与死亡组患者病毒载量都处于一个较高的水平,在多器官功能障碍期,存活组患者体内病毒开始逐渐清除,而死亡组患者病毒载量仍处于较高水平,对于判断疾病进展有一定的帮助。本研究局限之处是未对患者不同阶段的病毒载量进行对比研究,缺乏患者治疗过程中细胞因子水平变化的相关数据,无法判断细胞因子水平在SFTS疾病进展中的作用。
目前,SFTS患者的治疗仍以对症治疗为主,利巴韦林治疗SFTS存在争议性,血浆置换能够让进展迅速的SFTS患者临床特征和实验室指标得到改善,但是能否降低SFTS患者的病死率还未证实。目前一项回顾性研究[23]提示, 钙通道阻滞剂可有效降低SFTS病死率,也许可为SFTS治疗提供依据,开发有效预防SFTS疫苗以及治疗药物依旧是目前该疾病的研究重点。
综上所述,辽宁南部大连地区SFTS患者的临床特征和预后影响因素分析结果与辽宁东部地区无明显差异,但目前大连地区病死率却远高于辽宁东部等地区,大连地区高病死率的原因是否与两地病毒株和毒力差异,以及两地临床治疗差异等相关,需要进一步的研究阐明。
| [1] |
Yu XJ, Liang MF, Zhang SY, et al. Fever with thrombocytopenia associated with a novel bunyavirus in China[J]. N Engl J Med, 2011, 364(16): 1523-1532. DOI:10.1056/NEJMoa1010095 |
| [2] |
Adams MJ, Lefkowitz EJ, King AMQ, et al. Ratification vote on taxonomic proposals to the International Committee on Taxonomy of Viruses (2016)[J]. Arch Virol, 2016, 161(10): 2921-2949. DOI:10.1007/s00705-016-2977-6 |
| [3] |
唐霜, 沈姝, 史君明, 等. 布尼亚病毒目新分类概述[J]. 生物多样性, 2018, 26(9): 1004-1015. |
| [4] |
Kim KH, Yi J, Kim G, et al. Severe fever with thrombocytopenia syndrome, South Korea, 2012[J]. Emerg Infect Dis, 2013, 19(11): 1892-1894. |
| [5] |
Takahashi T, Maeda K, Suzuki T, et al. The first identification and retrospective study of severe fever with thrombocytopenia syndrome in Japan[J]. J Infect Dis, 2014, 209(6): 816-827. DOI:10.1093/infdis/jit603 |
| [6] |
McMullan LK, Folk SM, Kelly AJ, et al. A new phlebovirus associated with severe febrile illness in Missouri[J]. N Engl J Med, 2012, 367(9): 834-841. DOI:10.1056/NEJMoa1203378 |
| [7] |
Tran XC, Yun Y, Van An L, et al. Endemic severe fever with thrombocytopenia syndrome, Vietnam[J]. Emerg Infect Dis, 2019, 25(5): 1029-1031. DOI:10.3201/eid2505.181463 |
| [8] |
Miao D, Liu MJ, Wang YX, et al. Epidemiology and ecology of severe fever with thrombocytopenia syndrome in China, 2010-2018[J]. Clin Infect Dis, 2020, ciaa1561. DOI:10.1093/cid/ciaa1561.Epubaheadofprint |
| [9] |
Tang XY, Wu WL, Wang HF, et al. Human-to-human transmission of severe fever with thrombocytopenia syndrome bunya-virus through contact with infectious blood[J]. J Infect Dis, 2013, 207(5): 736-739. DOI:10.1093/infdis/jis748 |
| [10] |
Deng BC, Zhou B, Zhang SJ, et al. Clinical features and factors associated with severity and fatality among patients with severe fever with thrombocytopenia syndrome bunyavirus infection in Northeast China[J]. PLoS One, 2013, 8(11): e80802. DOI:10.1371/journal.pone.0080802 |
| [11] |
Deng BC, Zhang SJ, Geng YZ, et al. Cytokine and chemokine levels in patients with severe fever with thrombocytopenia syndrome virus[J]. PLoS One, 2012, 7(7): e41365. DOI:10.1371/journal.pone.0041365 |
| [12] |
中华人民共和国卫生部. 发热伴血小板减少综合征防治指南(2010版)[J]. 中华临床感染病杂志, 2011, 4(4): 193-194. |
| [13] |
Jia B, Wu WH, Huang R, et al. Characterization of clinical features and outcome for human-to-human transmitted severe fever with thrombocytopenia syndrome[J]. Infect Dis (Lond), 2018, 50(8): 601-608. DOI:10.1080/23744235.2018.1449962 |
| [14] |
Mao LL, Deng BC, Liang YH, et al. Epidemiological and genetic investigation of a cluster of cases of severe fever with thrombocytopenia syndrome bunyavirus[J]. BMC Infect Dis, 2020, 20(1): 346. DOI:10.1186/s12879-020-05072-w |
| [15] |
Ding SJ, Niu GY, Xu XH, et al. Age is a critical risk factor for severe fever with thrombocytopenia syndrome[J]. PLoS One, 2014, 9(11): e111736. DOI:10.1371/journal.pone.0111736 |
| [16] |
Chen YX, Jia B, Liu Y, et al. Risk factors associated with fatality of severe fever with thrombocytopenia syndrome: a Meta-analysis[J]. Oncotarget, 2017, 8(51): 89119-89129. DOI:10.18632/oncotarget.19163 |
| [17] |
崔宁, 杨振东, 王炳军, 等. 发热伴血小板减少综合征169例临床研究[J]. 中华内科杂志, 2012, 51(10): 755-758. DOI:10.3760/cma.j.issn.0578-1426.2012.10.005 |
| [18] |
Zhang SF, Yang ZD, Huang ML, et al. Preexisting chronic conditions for fatal outcome among SFTS patients: an observational cohort study[J]. PLoS Negl Trop Dis, 2019, 13(5): e0007434. DOI:10.1371/journal.pntd.0007434 |
| [19] |
Jia B, Yan XM, Chen YX, et al. A scoring model for predicting prognosis of patients with severe fever with thrombocytopenia syndrome[J]. PLoS Negl Trop Dis, 2017, 11(9): e0005909. DOI:10.1371/journal.pntd.0005909 |
| [20] |
Shin J, Kwon D, Youn SK, et al. Characteristics and factors associated with death among patients hospitalized for severe fever with thrombocytopenia syndrome, South Korea, 2013[J]. Emerg Infect Dis, 2015, 21(10): 1704-1710. DOI:10.3201/eid2110.141928 |
| [21] |
Gai ZT, Zhang Y, Liang MF, et al. Clinical progress and risk factors for death in severe fever with thrombocytopenia syndrome patients[J]. J Infect Dis, 2012, 206(7): 1095-1102. DOI:10.1093/infdis/jis472 |
| [22] |
Cui N, Bao XL, Yang ZD, et al. Clinical progression and predictors of death in patients with severe fever with thrombocytopenia syndrome in China[J]. J Clin Virol, 2014, 59(1): 12-17. DOI:10.1016/j.jcv.2013.10.024 |
| [23] |
Li H, Zhang LK, Li SF, et al. Calcium channel blockers reduce severe fever with thrombocytopenia syndrome virus (SFTSV) related fatality[J]. Cell Res, 2019, 29(9): 739-753. DOI:10.1038/s41422-019-0214-z |



