2. 长江大学附属第一医院消化内镜中心, 湖北 荆州 434000;
3. 南充市中心医院呼吸内科, 四川 南充 637003
2. Center of Digestive endoscopy, The First Affiliated Hospital of Yangtze University, Jingzhou 434000, China;
3. Department of Respiratory Diseases, Nanchong Central Hospital, Nanchong 637003, China
近几年,随着科学技术的快速发展,消化内镜技术已经逐步向超级微创过渡,并得到广泛应用[1]。在美国内镜技术每年的使用量超过百万人次,我国拥有更大的人口基数,接受内镜诊疗的患者数更多,内镜再处理不彻底成为危害患者健康的重要因素[2]。内镜结构复杂、构造精细,存在凹槽,患者的体液、血液以及黏膜组织容易黏附在管道缝隙中,从而成为医院感染的媒介[3-6]。随着管腔检测仪的出现,我们可用其观察到管腔内部的情况。研究[7-8]发现,刮痕是钳子管道内最常见的损伤情况,高达98.5%。尽管这些研究引起了人们广泛的关注,但是尚不清楚软式内镜管腔刮痕是否具有普遍性及内镜管腔的刮痕是否影响内镜再处理质量。因此,本研究使用管腔检测仪对162条内镜钳子管道内部进行观察,分析刮痕的分布情况,对每条内镜进行微生物检测,最后对刮痕严重、反复培养不合格的管腔进行拆卸,在扫描电镜下观察刮痕内的情况以评估刮痕对内镜再处理质量的影响。
1 对象与方法 1.1 研究对象选取某综合性医院162条再处理后的内镜钳子管道内部情况进行调查,内镜品牌为奥林巴斯(Olympus,日本)、富士(Fuji,日本)和宾德(Pentax Medical,日本)。
1.2 方法 1.2.1 试验材料管腔检测仪(高精度超细管腔检测仪,美国Healthmark工业公司),长110 cm,直径1.9 mm,镜头放大倍数达50倍,可进入内镜钳子管道内拍摄分辨率800×800像素的视频和照片。移动工作车(美国Healthmark工业公司,美国),扫描电镜(日本JEOL公司,JSM-6701F)。
1.2.2 管腔检测仪观察步骤在观察每条内镜前使用含75%乙醇的无菌纱布擦拭管腔检测仪和移动工作车,干燥5 min后,移动工作车铺上无菌巾,以便放置待检测的内镜。研究人员手持管腔检测仪先从内镜先端部的钳子管道出口进入,直到管腔检测仪全部进入钳子管道,再从内镜操作部的钳子管道入口推进,并根据管腔内部的具体情况来减慢观察速度,以确保观察到清晰、完整的钳子管道内部。
1.2.3 采样方法严格按照《医院消毒卫生标准》GB 15982—2012[9]规定,在无菌条件下取洗脱液1 mL接种于营养琼脂培养基,再取1 mL重复以上步骤接种于平皿,将剩余48 mL洗脱液用滤膜(0.45 μm)过滤浓缩,将滤膜接种于平皿上(注意不要产生气泡),置(36±1)℃温箱培养48 h,计数菌落数。
1.2.4 电镜标本制备与观察将刮痕严重、反复培养阳性的钳子管道拆卸后纵向剖开,置于戊二醛中固定,PBS冲洗,乙醇脱水,醋酸异戊酯置换,CO2临界点干燥,离子溅射仪喷金,扫描电镜下观察刮痕内情况并拍照。
1.2.5 判断标准按照《医院消毒卫生标准》GB 15982—2012的规定以内镜管腔菌落数≤20 CFU/100 mL判定为合格。内镜管腔刮痕情况的判定:由1名管腔检测仪研发人员(博士)、1名资深内镜医生(内镜诊疗量>1 000例/年)和3名内镜专科护士(硕士)观看管腔检测仪下的视频后,共同对刮痕的边缘、颜色和长度进行分类。
1.3 统计学方法应用Excel 2013录入数据,SPSS 25.0统计软件处理数据,计数资料采用例(%)表示,组间比较采用χ2检验或者Fisher’s确切概率法,P≤0.05为差异具有统计学意义。
2 结果 2.1 钳子管道内的刮痕分布情况对再处理后的162条内镜钳子管道情况进行调查,包括76条胃镜、73条肠镜、5条超声内镜、8条十二指肠镜,调查期间发现148条(91.36%)内镜存在刮痕。其中,胃镜刮痕发生率最高,达97.37%(74/76)。操作部钳子管道入口金属部分0~5 cm及先端部特氟龙材质管腔0~10 cm刮痕发生最频繁,分别占84.46%、52.03%。刮痕随着内镜使用时长的增加而逐渐增加,使用时长达24个月之后,刮痕发生率达100%。在管腔检测仪下,肉眼观察刮痕呈无色、黑色及黄色。见表 1。
| 表 1 不同分类软式内镜管腔刮痕检出情况 Table 1 Detection of scratches in lumen of different types of flexible endoscopes |
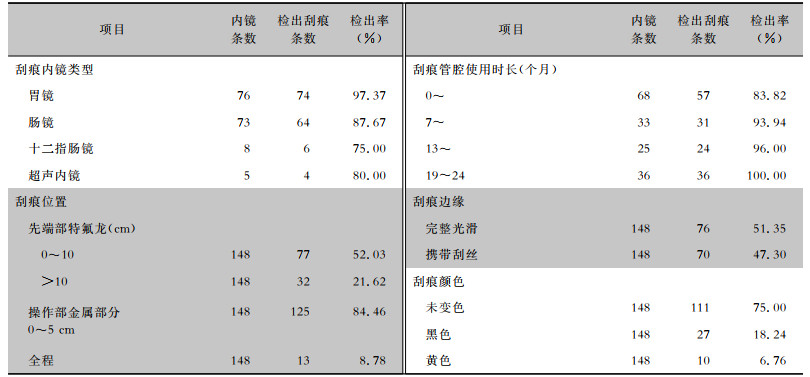
|
在管腔检测仪下可以观察到,内镜先端部进入直到内镜刻度终点均为特氟龙材质,表面呈螺旋状或者光滑状;内镜操作部钳子管道入口0~5 cm均为金属材质,表面光滑。管腔检测仪下拍摄的刮痕情况见图 1。
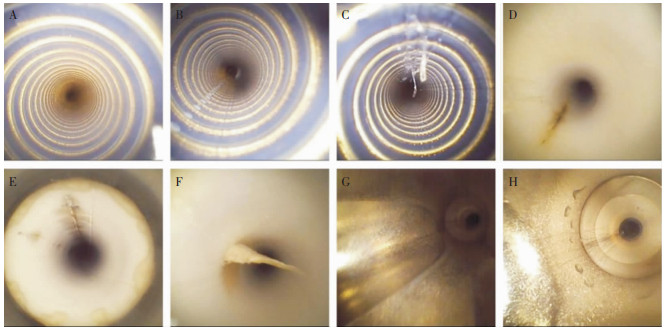 |
| A:GIF-HQ290全新未使用的特氟龙管腔;B:GIF-HQ290使用1周后先端部特氟龙管腔0~10 cm轻微刮痕;C:GIF-Q260使用2个月后先端部特氟龙管腔4 cm出现刮痕伴刮丝;D:GIF-Q260J使用5个月先端部1 cm出现较深的黑色刮痕;E:GIF-Q260J使用6个月先端部特氟龙管腔3 cm处出现黑色刮痕伴斑块;F:GIF-H290使用1年先端部3 cm处出现刮痕;G:GIF-HQ290全新未使用的操作部金属管腔;H:GIF-HQ290使用1周后操作部金属部分出现轻微刮痕。 图 1 管腔检测仪下拍摄的刮痕情况 Figure 1 Scratch photographed under borescope |
111条内镜管腔刮痕未发生变色,其中10条内镜(9.01%)微生物检测不合格。27条内镜管腔出现黑色刮痕,其中5条(18.52%)微生物检测不合格。10条内镜管腔出现黄色刮痕,其中2条(20.00%)微生物检测不合格,14条内镜管腔完好,未发生刮痕,微生物检测合格率为100.00%。不同刮痕颜色微生物检测不合格率比较,差异无统计学意义(P>0.05)。见表 2。
| 表 2 不同类型刮痕内镜细菌培养不合格情况 Table 2 Unqualified result of bacterial culture of endoscopes with different types of scratches |
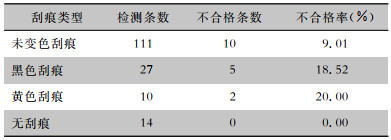
|
本次试验从148条刮痕内镜中选取出1条微生物反复检测不合格且使用时长达5个月的GIF-Q260J胃镜,取先端部1 cm黑色刮痕管腔在扫描电镜下观察,显示纵横交错的生物膜。见图 2。
 |
| 图 2 黑色刮痕内镜不同倍数电镜扫描图 Figure 2 Scanning electron microscope images of endoscopic black scratch at different levels of magnification |
据报道,内镜检查后所引起的医源性感染发病率高于任何其他医疗设备相关的感染[10]。美国约翰霍普金斯大学流行病学调查显示,内镜检查后相关感染发病率达3‰[11]。《美国感染控制杂志》最新数据显示,经过高水平消毒后的胃肠镜、十二指肠镜等微生物检出率高达60%~92%[12]。我国内镜污染状况同样不容乐观,胃肠镜高水平消毒后合格率仅为33%~66%[13]。由此可见,软式内镜再处理质量相关问题需得到重视。
本研究结果表明,内镜管腔刮痕的发生率高达91.36%,其中52.03%的刮痕位于先端部钳子管道出口0~10 cm的特氟龙管道内,主要是诊疗过程中使用的治疗附件,如注射针、止血夹、活检钳等反复通过盘曲的内镜钳子管道时刮伤腔道造成[14]。一旦刮伤钳子管道,微生物易在此缝隙中积聚,造成清洗消毒困难。84.46%的刮痕位于操作部钳子管道入口0~5 cm的金属材质管腔内,主要原因是钳子管道入口通向插入部的管腔呈45°,在使用质地较硬的毛刷刷洗或者推送诊疗附件时容易在钳子管道入口内金属及连接部位形成刮痕。为了避免钳子管道发生损伤,在推送附件或者在手工刷洗时,尽可能将角度钮恢复原位并匀速推送诊疗附件,且不使用硬质金属的清洗刷。
本研究发现,内镜管腔中的部分刮痕呈黑色或者黄色,甚至在刮痕区域发现变色斑块,提示刮痕缝隙内极有可能积聚生物膜,影响内镜再处理质量。为了验证这一猜想,本研究团队对162条内镜钳子管腔进行采样及微生物检测,结果显示黑色刮痕和黄色刮痕组微生物检测不合格率均高于无色刮痕组和无刮痕组。因此,建议定期对内镜管腔进行检查,特别需要关注使用时间2年及以上的内镜,及早发现变色刮痕并更换钳子管道,从而将感染传播风险降到最低。
研究者将变色刮痕的管腔拆卸,在电镜下观察到纵横交错的生物膜。管腔内隐匿的刮痕、细微凹凸、细小缝隙均为生物膜生长发育提供了良好的生长环境。其次,内镜管腔的生物膜通过多轮反复接触患者、清洗、消毒、灭菌和干燥等,每一轮内镜表面生物膜都接触化学物质(例如消毒剂或灭菌剂),这些化学物质可以将残留物固定在刮痕缝隙内,导致生物膜对刮痕黏附更加紧实,更加难以去除[15]。
清洗刷是内镜手工清洗环节最重要的工具之一[16]。目前国内外主要使用内镜管腔专用清洗刷、双头阀门刷以及内镜管腔活塞刷等三种清洗刷。本研究使用管腔检测仪进入内镜管腔观察上述三种类型清洗刷在管腔内的刷洗情况,结果发现,上述三种清洗刷存在以下几种弊端:前两者内镜清洗刷刷毛密度和硬度不合适,进入管腔后,刷毛无法保持刷洗的效果,因此难以清除刮痕缝隙中的微生物;后者清洗刷无刷毛,同样无法深入刮痕缝隙内,将刮痕内的微生物彻底清除,反而在力学作用下,使刮痕内的微生物黏附更加紧实。因此,发明一种契合性好、刷洗效果更显著的清洗刷迫在眉睫。
本次调查采用管腔检测仪对内镜钳子管道内部情况进行目视检测,直观的反映内镜管腔内部的刮痕情况,这些刮痕势必对清洗和高水平消毒的效果造成影响。提示需要使用管腔检测仪对内镜钳子管道内部情况进行定期目视检查,特别需要关注使用时长超过2年的内镜,及时发现钳子管道内的刮痕情况,进行保养或维修更换。其次,本研究调查发现管腔内存在黑色和黄色刮痕,提示需要进一步提高手工刷洗和高水平消毒的质量,去除刮痕内隐匿性微生物,避免内镜相关感染事件的发生。
| [1] |
令狐恩强. 消化内镜学的发展方向和未来——中华医学会消化内镜学分会的工作[J]. 中华胃肠内镜电子杂志, 2019, 6(4): 161-162. DOI:10.3877/cma.j.issn.2095-7157.2019.04.003 |
| [2] |
Holshue ML, DeBolt C, Lindquist S, et al. First case of 2019 novel coronavirus in the United States[J]. N Engl J Med, 2020, 382(10): 929-936. DOI:10.1056/NEJMoa2001191 |
| [3] |
Wu RP, Xi HJ, Qi K, et al. Correlation between the growth of bacterial biofilm in flexible endoscopes and endoscope reprocessing methods[J]. Am J Infect Control, 2014, 42(11): 1203-1206. DOI:10.1016/j.ajic.2014.07.029 |
| [4] |
Epstein L, Hunter JC, Arwady MA, et al. New Delhi metallo-β-lactamase-producing carbapenem-resistant Escherichia coli associated with exposure to duodenoscopes[J]. JAMA, 2014, 312(14): 1447-1455. DOI:10.1001/jama.2014.12720 |
| [5] |
Humphries RM, McDonnell G. Superbugs on duodenoscopes: the challenge of cleaning and disinfection of reusable devices[J]. J Clin Microbiol, 2015, 53(10): 3118-3125. DOI:10.1128/JCM.01394-15 |
| [6] |
Alfa MJ, Singh H. Impact of wet storage and other factors on biofilm formation and contamination of patient-ready endoscopes: a narrative review[J]. Gastrointest Endosc, 2020, 91(2): 236-247. DOI:10.1016/j.gie.2019.08.043 |
| [7] |
Ofstead CL, Quick MR, Wetzler HP, et al. Effectiveness of reprocessing for flexible bronchoscopes and endobronchial ultrasound bronchoscopes[J]. Chest, 2018, 154(5): 1024-1034. DOI:10.1016/j.chest.2018.04.045 |
| [8] |
Barakat MT, Girotra M, Huang RJ, et al. Scoping the scope: endoscopic evaluation of endoscope working channels with a new high-resolution inspection endoscope (with video)[J]. Gastrointest Endosc, 2018, 88(4): 601-611. e1. DOI:10.1016/j.gie.2018.01.018 |
| [9] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. 医院消毒卫生标准: GB 15982-2012[S]. 北京: 中国标准出版社, 2012.
|
| [10] |
Reprocessing Guideline Task Force, Petersen BT, Cohen J, et al. Multisociety guideline on reprocessing flexible GI endoscopes: 2016 update[J]. Gastrointest Endosc, 2017, 85(2): 282-294. DOI:10.1016/j.gie.2016.10.002 |
| [11] |
Wang PQ, Xu T, Ngamruengphong S, et al. Rates of infection after colonoscopy and osophagogastroduodenoscopy in ambulatory surgery centres in the USA[J]. Gut, 2018, 67(9): 1626-1636. DOI:10.1136/gutjnl-2017-315308 |
| [12] |
Ofstead CL, Hopkins KM, Eiland JE, et al. Widespread clinical use of simethicone, insoluble lubricants, and tissue glue during endoscopy: a call to action for infection preventionists[J]. Am J Infect Control, 2019, 47(6): 666-670. DOI:10.1016/j.ajic.2019.02.012 |
| [13] |
何荣攀, 周梦娇, 胡露, 等. 三种过氧乙酸对消化内镜消毒效果的研究[J]. 中国消毒学杂志, 2020, 37(5): 332-334, 338. |
| [14] |
Thaker AM, Kim S, Sedarat A, et al. Inspection of endoscope instrument channels after reprocessing using a prototype borescope[J]. Gastrointest Endosc, 2018, 88(4): 612-619. DOI:10.1016/j.gie.2018.04.2366 |
| [15] |
Pajkos A, Vickery K, Cossart Y. Is biofilm accumulation on endoscope tubing a contributor to the failure of cleaning and decontamination?[J]. J Hosp Infect, 2004, 58(3): 224-229. DOI:10.1016/j.jhin.2004.06.023 |
| [16] |
Hervé R, Keevil CW. Current limitations about the cleaning of luminal endoscopes[J]. J Hosp Infect, 2013, 83(1): 22-29. DOI:10.1016/j.jhin.2012.08.008 |



