2. 株洲市中心医院 中南大学湘雅医学院附属株洲医院医务部质控办, 湖南 株洲 412007;
3. 株洲市中心医院 中南大学湘雅医学院附属株洲医院急诊科, 湖南 株洲 412007
2. Medical Administration Department, Zhuzhou Central Hospital, Zhuzhou Hospital Affiliated to Xiangya School of Medicine, Central South University, Zhuzhou 412007, China;
3. Emergency Department, Zhuzhou Central Hospital, Zhuzhou Hospital Affiliated to Xiangya School of Medicine, Central South University, Zhuzhou 412007, China
人类鹦鹉热是一种人畜共患传染病,是由专性胞内的鹦鹉热衣原体在肝和脾的单核吞噬细胞内复制后,通过血液传播到肺和其他器官[1]。肺是最常见的受累器官,可导致严重的临床表现,包括重症肺炎、成人呼吸窘迫综合征等[2-3]。在过去十年中,鹦鹉热衣原体肺炎病例报告逐渐增多,但仍是一种不常见的疾病,约占每年社区获得性肺炎(CAP)病例的1%~2%[4]。鹦鹉热衣原体肺炎临床表现多变,临床医生对该病的认识程度低,容易忽视而导致漏诊或误诊。同时,鹦鹉热衣原体肺炎早期诊断困难,病情发展迅速,若不及时明确诊断并使用敏感抗菌药物,患者可能短时间出现呼吸衰竭甚至死亡。宏基因组二代测序(mNGS)技术为鹦鹉热衣原体肺炎的快速诊断提供了一个新工具。现对某院收治的确诊为鹦鹉热衣原体肺炎患者的临床资料进行回顾性分析,以提高临床对该病的认识和诊治能力。
1 资料与方法 1.1 资料来源收集2019年6月—2021年8月由湖南省株洲市中心医院收治的9例鹦鹉热衣原体肺炎患者临床资料,所有患者经肺泡灌洗液(BALF)和外周血mNGS检测确诊。本研究经该院伦理委员会审查批准(批准号:ZZCHEC126-01)。
1.2 研究方法从病例系统收集患者基本信息,包括年龄、性别、基础疾病、临床表现、治疗方法及疗效;检验系统采集患者实验室检查结果,包括血常规、C-反应蛋白(CRP)、红细胞沉降率(ESR)、降钙素原(PCT)、肝肾功能、动脉血气分析;CT影像中心收集患者胸部CT资料,同时收集患者病理检查资料。
1.3 mNGS检测严格按照临床操作规范收集患者外周血和BALF标本,置于干冰中运输,送武汉华大医学检验所行mNGS检测。
1.4 病理学检查取脐带和胎盘标本,放入10%中性甲醛中固定,24 h以后逐级乙醇脱水,制作病理标本,行HE染色,观察脐带和胎盘组织中是否有中性粒细胞浸润。
1.5 统计学方法应用SPSS 22.0统计学软件进行数据管理和描述性分析,计数资料采用例数进行描述,计量资料采用均数±标准差(x±s)进行描述。
2 结果 2.1 一般资料9例患者中男性7例,女性2例,包含1例妊娠36+2周孕妇;年龄25~73岁,中位年龄63岁。既往患高血压3例,慢性乙型病毒性肝炎2例,冠心病1例,糖尿病1例,酒精性肝硬化1例,干燥综合征1例。7例患者有鸟、鸽、狗和家禽接触史,2例无明确接触史。见表 1。
| 表 1 9例鹦鹉热衣原体肺炎患者临床资料 Table 1 Clinical data of 9 patients with C. psittaci pneumonia |
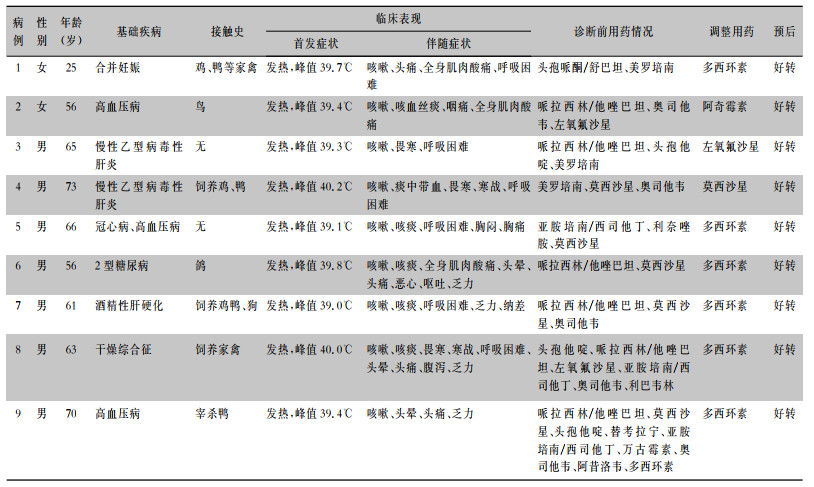
|
9例患者均表现为高热,体温峰值为39.0~40.2℃,平均(39.5±0.4)℃。9例患者均有咳嗽,其中2例为干咳,2例出现痰中带血。6例患者病程中出现呼吸困难。其余伴随症状包括乏力(4例),全身肌肉酸痛(3例),畏寒(3例),寒战(2例),头晕(3例),头痛(4例),胸痛(1例),恶心呕吐(1例)。重症肺炎6例(病例1、4、5、7、8、9)入住重症监护室(ICU),其中3例行气管插管及机械通气治疗,均为初始治疗效果不佳病情逐渐进展。见表 1。
2.3 实验室检查9例患者中,8例白细胞计数正常,仅1例升高;7例中性粒细胞百分比(NE%)增高(>70%),2例正常;所有患者CRP均升高,初诊时为107.6~436.6 mg/L,均值为(228.8±118.8)mg/L;4例患者PCT正常,4例升高;所有患者血沉升高,初诊时为63~116 mm/1 h,均值为(84.7±17.9)mm/1 h;7例患者门冬氨酸氨基转移酶(AST)升高,初诊时为31~1 417 U/L,均值为(240.8±446)U/L,6例患者丙氨酸氨基转移酶(ALT)升高,初诊时为24~237 U/L,均值为(85.8±67.0)U/L,仅2例AST和ALT同时在正常范围;此外,所有患者淋巴细胞均降低,8例患者清蛋白降低。见表 2。
| 表 2 9例鹦鹉热衣原体肺炎实验室检查结果及胸部CT表现 Table 2 Laboratory examination results and chest CT findings of 9 patients with C. psittaci pneumonia |
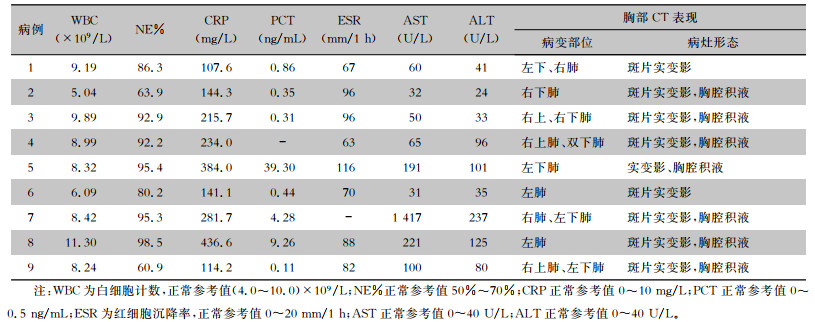
|
除妊娠或病情不允许时行床旁胸片检查,剖宫产及病情好转后都接受了胸部CT检查,病变以双侧多见(5例),左侧发生者次之(3例),右侧发生者较少(1例)。所有患者胸部CT均表现为斑片或斑片实变影(9例),病灶范围均较大,其中7例伴有少量胸腔积液(7例)。见表 1、图 1。
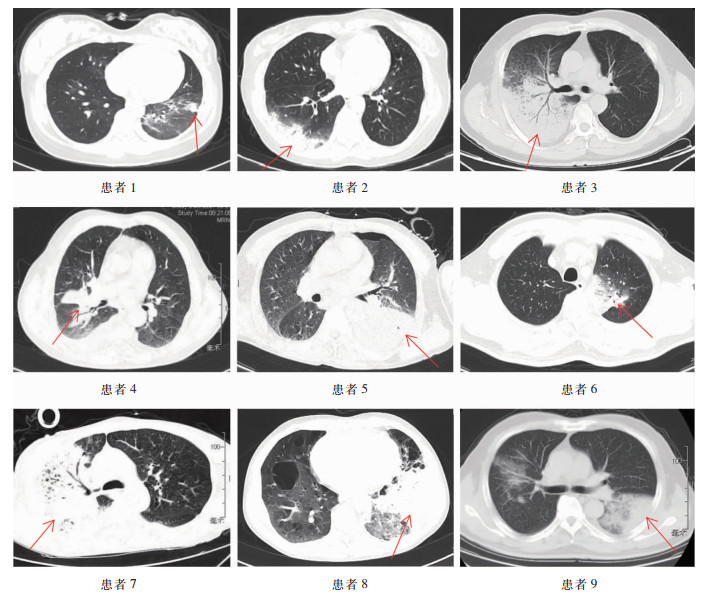 |
| 患者1:入院8 d胸部CT可见右肺磨玻璃影,左下肺斑片实变影;患者2:入院4 d胸部CT可见右下肺斑片实变影,伴胸腔积液;患者3:入院4 d胸部CT可见右上肺斑片实变影,伴胸腔积液;患者4:入院13 d胸部CT可见右上肺、双下肺斑片实变影,伴胸腔积液;患者5:入院1 d胸部CT可见左下肺实变影,伴右侧胸腔积液;患者6:入院1 d胸部CT可见左上肺斑片实变影;患者7:入院6 d胸部CT可见右肺及左下肺斑片及实变影,伴胸腔积液;患者8:入院1 d胸部CT可见左肺斑片及实变影,伴胸腔积液;患者9:入院1 d胸部CT可见右上肺、左下肺斑片实变影,伴胸腔积液。 图 1 9例鹦鹉热衣原体肺炎患者胸部CT影像图 Figure 1 Chest CT images of 9 patients with C. psittaci pneumonia |
6例患者通过BALF,2例患者通过外周血,1例同时行肺泡灌洗液(BALF)及外周血行mNGS检测明确诊断。经mNGS检测出病原体除鹦鹉热衣原体外,2例检出肺炎克雷伯菌序列数,2例同时检出流产衣原体序列数,1例检出铜绿假单胞菌序列数,1例检出盲肠肠球菌序列数,1例检出鲍曼不动杆菌、细环病毒序列数,考虑多为背景菌或者定植菌。见表 3。
| 表 3 9例鹦鹉热衣原体肺炎患者mNGS检测结果 Table 3 mNGS test results of 9 patients with C. psittaci pneumonia |
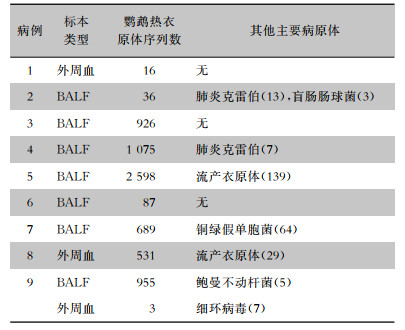
|
在明确诊断前所有患者均接受了经验性抗感染药物治疗,所有患者使用了2种及以上抗感染药物,其中1例先后使用了9种抗感染药物(病例9)。7例病程中使用了左氧氟沙星、莫西沙星治疗,仅1例使用了多西环素。明确诊断后5例单用多西环素,1例单用莫西沙星治疗,1例单用阿奇霉素治疗,1例单用左氧氟沙星治疗。病例9诊断鹦鹉热衣原体肺炎后合并铜绿假单胞菌及鲍曼不动杆菌感染,予以多西环素联合头孢哌酮/舒巴坦、替加环素等治疗。病例1剖宫产娩出一活女新生儿,新生儿无发热,状况良好,胎盘及脐带病理检查(见图 2)未见感染征象。9例患者体温恢复正常,咳嗽、呼吸困难等症状明显缓解,均好转出院。
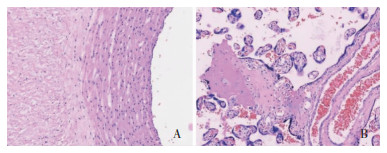 |
| A:脐带血管未见中性粒细胞浸润;B:胎盘中未见中性粒细胞浸润。 图 2 鹦鹉热衣原体肺炎患者脐带和胎盘标本HE染色结果(×200,患者1) Figure 2 HE staining of the umbilical cord and placenta of patients with C. psittaci pneumonia (×200, patient 1) |
鹦鹉热衣原体是一种革兰阴性专性细胞内细菌,可导致严重的鹦鹉热。鹦鹉热衣原体肺炎通常发生在接触有传染性的鸟类或病禽羽毛、粪便或其他物质后,潜伏期一般为7~15 d[5]。此外,研究表明,马是一种新的传染源[6],也有人传人的报道,但这种途径较罕见[7]。本研究中,大部分患者(7例)可追问到鸽、鸟、家禽、狗等接触史,2例否认鸟禽类、狗及马的接触史,病原体的来源不明确。对于有鸟类或家禽接触史的发热患者,需警惕鹦鹉热衣原体感染。
鹦鹉热临床表现从无症状感染到多器官受累,如孕妇流产、致死性脑膜炎、重症肺炎等[8]。发病症状通常是突然出现的高热,伴有咳嗽、头痛、寒战、乏力和肌痛等,临床症状表现多样,疾病严重程度各不相同。Knittler等[9]研究表明,鹦鹉热衣原体致病性强,繁殖速度比其他衣原体更快,引起的炎症反应更严重,因此,重症病例相对较多见。本研究中6例患者表现为重症肺炎入住ICU,其中3例行气管插管、有创机械通气治疗,另外3例需行无创通气治疗。9例患者均表现为高热伴咳嗽,多数患者有咳痰,多为少量白黏痰,伴有乏力、头晕、头痛、全身肌肉酸痛等流感样症状。胸痛和咯血并不常见,1例患者出现胸痛,2例患者出现痰中带血,2例患者出现恶心、呕吐及腹泻等症状,考虑累及消化系统。在急性期,近90%的患者白细胞计数在正常范围内或处于较低水平,本研究中仅1例患者白细胞升高,与既往研究[10]一致。绝大多数患者淋巴细胞计数下降,表明鹦鹉热衣原体肺炎患者免疫在感染开始时受到抑制,提示鹦鹉热衣原体可能容易在免疫功能低下的宿主中引起感染。桂前乐等[11]研究显示,50%鹦鹉热衣原体肺炎患者合并有慢性乙型病毒性肝炎和酒精性肝硬化等慢性肝病。本研究中也有3例合并慢性乙型病毒性肝炎和酒精性肝硬化。而慢性肝病会导致免疫力低下,慢性肝病可能是该病的诱发因素。在初始血检中CRP及ESR均升高,可作为除体温外判断治疗效果的客观指标。PCR一般正常,脓毒症患者可显著升高,可能与合并细菌感染相关。本研究有半数患者血清AST、ALT升高,考虑与肝损伤有关[8]。
虽然鹦鹉热衣原体肺炎的影像学特征不足以与其他类型的CAP区分开来,但仍具有一定的特征性。90%的住院病例中出现异常胸片,常表现为不同程度的渗出和实变,斑片状影和网状浸润是最常见的表现。胸部CT多表现为斑片状或大片融合的斑片实变影,沿肺段分布,以下叶受累为主,偶有胸腔积液。一些严重的病例也可出现肺叶大片影和广泛的双侧肺炎[8, 12]。文文等[13]研究显示,鹦鹉热肺炎患者胸部CT多表现为斑片状磨玻璃影或大片融合的实变影,25%患者病变位于双侧肺叶,仅12.5%患者出现胸腔积液。而徐欢等[10]研究表明,鹦鹉热肺炎患者胸部CT多表现为肺实变伴支气管充气征,27%患者病变累及双侧肺叶,超过80%患者胸部CT出现胸腔积液。在本研究中,9例患者胸部影像学均表现为斑片或大片斑片实变影,病灶多位于双侧肺叶(4例),且临床表现更为严重,多伴胸腔积液(7例)。由于本研究和既往研究的样本量都较少,结论有一定的局限性。
既往鹦鹉热衣原体肺炎的临床报道少见,原因一方面是其发病率低,另一方面则是常规临床检测方法有限、敏感率低,因此诊断率不高。鹦鹉热衣原体肺炎确诊主要包括病原体培养和血清学试验。目前实时聚合酶链反应(PCR)已取代培养,是检测鹦鹉热衣原体的金标准[14]。mNGS对病原菌鉴定具有较高的敏感性。通过检测血液、BALF等检测鹦鹉热衣原体的mNGS在临床上已应用较广泛[13, 15]。此外,mNGS受先前抗生素暴露的影响较小,对于复杂感染性疾病病原体的检测是一种非常有前景的方法[16-17]。在本研究中,9例患者均通过mNGS检测出鹦鹉热衣原体,其中1例同时送检了BALF和外周血标本,鹦鹉热衣原体序列数分别为955和3,外周血标本检出序列数明显减少。
鹦鹉热衣原体肺炎最有效的抗菌药物是四环素类药物,包括多西环素或四环素等。氟喹诺酮类药物,如莫西沙星和左氧氟沙星,也对鹦鹉热衣原体有效[18]。轻度至中度症状患者可口服多西环素或米诺环素治疗,重症患者则需静脉滴注多西环素治疗,甚至需要联合喹诺酮类药物。一般四环素类抗生素治疗后24~48 h内有反应,体温下降是治疗有效的直接表现。治疗疗程至少14 d,最好是21 d,否则治疗不充分,容易导致疾病复发。当四环素类药物有用药禁忌时,尤其是妊娠早期,大环内酯类抗生素,如阿奇霉素可能是最佳选择[19]。在本研究中,多数患者在确诊前使用了喹诺酮类药物,但部分患者治疗效果不佳,原因一是部分患者本身对喹诺酮类药物治疗无效;二是重症患者病变广泛,抗菌药物使用时间较短,疗效未显现。本研究中,病例1为妊娠期鹦鹉热,终止妊娠后给予多西环素治疗,产妇发热、气促等症状很快好转,且新生儿无感染。病例5和7初始使用了莫西沙星,效果不佳,病情进展迅速,需气管插管及机械通气治疗,明确诊断后改用多西环素治疗后病情明显改善。病例9明确诊断前使用多西环素,但仍反复发热,后续痰细菌培养显示铜绿假单胞菌和鲍曼不动杆菌,联合敏感抗生素治疗后病情好转。因此,建议明确诊断后首选多西环素,重症患者可考虑联合使用喹诺酮类药物。
总之,鹦鹉热衣原体肺炎临床表现多样、诊断困难,mNGS检测可以快速明确病原学诊断,有助于及时启动特异性抗感染治疗,可减少抗菌药物的使用,改善预后。一旦怀疑或诊断鹦鹉热衣原体肺炎,可选择使用多西环素治疗,对于妊娠期鹦鹉热肺炎,早期分娩胎儿可获得良好的母婴结局。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Corsaro D, Greub G. Pathogenic potential of novel chlamydiae and diagnostic approaches to infections due to these obligate intracellular bacteria[J]. Clin Microbiol Rev, 2006, 19(2): 283-297. DOI:10.1128/CMR.19.2.283-297.2006 |
| [2] |
史兰萍, 李阳. 鹦鹉热衣原体重症肺炎1例[J]. 中国感染与化疗杂志, 2019, 19(3): 309-311. Shi LP, Li Y. One case of severe pneumonia caused by Chlamydia psittaci[J]. Chinese Journal of Infection and Chemotherapy, 2019, 19(3): 309-311. |
| [3] |
赵仁淹, 柴海娜, 郑瑞强. 病原体二代测序辅助诊断鹦鹉热衣原体重症肺炎一例[J]. 中华内科杂志, 2020, 59(12): 989-991. Zhao RY, Chai HN, Zheng RQ. A case report of critical psittaci pneumonia diagnosed by next-generation sequencing[J]. Chinese Journal of Internal Medicine, 2020, 59(12): 989-991. DOI:10.3760/cma.j.cn112138-20200229-00157 |
| [4] |
Wu XD, Li YY, Zhang M, et al. Etiology of severe community-acquired pneumonia in adults based on metagenomic next-generation sequencing: a prospective multicenter study[J]. Infect Dis Ther, 2020, 9(4): 1003-1015. DOI:10.1007/s40121-020-00353-y |
| [5] |
Hogerwerf L, Roof I, de Jong MJK, et al. Animal sources for zoonotic transmission of psittacosis: a systematic review[J]. BMC Infect Dis, 2020, 20(1): 192. DOI:10.1186/s12879-020-4918-y |
| [6] |
Jenkins C, Jelocnik M, Micallef ML, et al. An epizootic of Chlamydia psittaci equine reproductive loss associated with suspected spillover from native Australian parrots[J]. Emerg Microbes Infect, 2018, 7(1): 88. |
| [7] |
Balsamo G, Maxted AM, Midla JW, et al. Compendium of measures to control Chlamydia psittaci infection among humans (psittacosis) and pet birds (avian chlamydiosis), 2017[J]. J Avian Med Surg, 2017, 31(3): 262-282. DOI:10.1647/217-265 |
| [8] |
Shi YF, Chen JX, Shi XH, et al. A case of Chlamydia psittaci caused severe pneumonia and meningitis diagnosed by me-tagenome next-generation sequencing and clinical analysis: a case report and literature review[J]. BMC Infect Dis, 2021, 21(1): 621. DOI:10.1186/s12879-021-06205-5 |
| [9] |
Knittler MR, Sachse K. Chlamydia psittaci: update on an underestimated zoonotic agent[J]. Pathog Dis, 2015, 73(1): 1-15. |
| [10] |
徐欢, 朱晓维, 朱星星. 鹦鹉热肺炎11例临床特征分析[J]. 浙江医学, 2021, 43(12): 1332-1334. Xu H, Zhu XW, Zhu XX. Clinical characteristics of psittacosis pneumonia in 11 cases[J]. Zhejiang Medical Journal, 2021, 43(12): 1332-1334. DOI:10.12056/j.issn.1006-2785.2021.43.12.2021-725 |
| [11] |
桂前乐, 邵敏, 孙耕耘, 等. 6例鹦鹉热衣原体重症肺炎的临床特点分析[J]. 中国急救医学, 2021, 41(8): 698-703. Gui QL, Shao M, Sun GY, et al. Clinical analysis of 6 cases of severe Chlamydia psittaci pneumonia[J]. Chinese Journal of Critical Care Medicine, 2021, 41(8): 698-703. DOI:10.3969/j.issn.1002-1949.2021.08.010 |
| [12] |
Rybarczyk J, Versteele C, Lernout T, et al. Human psittacosis: a review with emphasis on surveillance in Belgium[J]. Acta Clin Belg, 2020, 75(1): 42-48. DOI:10.1080/17843286.2019.1590889 |
| [13] |
文文, 谷雷, 赵立维, 等. 鹦鹉热衣原体肺炎八例临床特征分析及其诊治[J]. 中华结核和呼吸杂志, 2021, 44(6): 531-536. Wen W, Gu L, Zhao LW, et al. Diagnosis and treatment of Chlamydia psittaci pneumonia: experiences of 8 cases[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2021, 44(6): 531-536. DOI:10.3760/cma.j.cn112147-20210205-00097 |
| [14] |
Nieuwenhuizen AA, Dijkstra F, Notermans DW, et al. Laboratory methods for case finding in human psittacosis outbreaks: a systematic review[J]. BMC Infect Dis, 2018, 18(1): 442. DOI:10.1186/s12879-018-3317-0 |
| [15] |
Chen XC, Cao K, Wei Y, et al. Metagenomic next-generation sequencing in the diagnosis of severe pneumonias caused by Chlamydia psittaci[J]. Infection, 2020, 48(4): 535-542. DOI:10.1007/s15010-020-01429-0 |
| [16] |
Miao Q, Ma YY, Wang QQ, et al. Microbiological diagnostic performance of metagenomic next-generation sequencing when applied to clinical practice[J]. Clin Infect Dis, 2018, 67(suppl_2): S231-S240. DOI:10.1093/cid/ciy693 |
| [17] |
Fischer N, Rohde H, Indenbirken D, et al. Rapid metageno-mic diagnostics for suspected outbreak of severe pneumonia[J]. Emerg Infect Dis, 2014, 20(6): 1072-1075. DOI:10.3201/eid2006.131526 |
| [18] |
Kohlhoff SA, Hammerschlag MR. Treatment of chlamydial infections: 2014 update[J]. Expert Opin Pharmacother, 2015, 16(2): 205-212. DOI:10.1517/14656566.2015.999041 |
| [19] |
Katsura D, Tsuji S, Kimura F, et al. Gestational psittacosis: a case report and literature review[J]. J Obstet Gynaecol Res, 2020, 46(5): 673-677. DOI:10.1111/jog.14217 |



