2. 南京大学医学院附属鼓楼医院感染管理办公室, 江苏 南京 210008
2. Infection Management Office, Nanjing Drum Tower Hospital, The Affiliated Hospital of Nanjing University Medical School, Nanjing 210008, China
伴随医疗技术的发展,消化内镜中心的诊疗模式已从单纯的诊断转变为集诊断、治疗、微创手术为一体[1],这种转变使内镜再处理的感染风险也随之增加[2]。储存是软式内镜再处理最后一个环节[3]。研究[4]表明,不正确的储存会导致内镜再处理失败。内镜再处理过程中的难点之一是附着物品表面的生物膜[5-6]。研究[7]发现,临床实践过程中使用的内镜出现生物膜的生长与不完全干燥有关,且积聚的生物膜是微生物持续存在的重要原因。同时,潮湿的环境十分有利于微生物的生长和繁殖[8]。虽然现在普遍意识到储存过程中内镜表面及管腔保持干燥的重要性[9],但是目前内镜储存前和储存过程中的干燥方法及评价方式在很多指南中是模糊的[3, 10], 且国内外内镜干燥不合格的现状普遍存在。
内镜安全储存时间在各国指南中均存在较大差异[11]。欧洲消化内镜协会(ESGE)[12]提出由医疗机构进行安全储存的风险评估,其中重要的一点就是评估再处理后内镜是潮湿还是干燥。美国胃肠病护士学会(SGNA)[13]建议合理的储存可使内镜免于使用前的再次消毒。我国现阶段要求每日开始内镜诊疗工作前将预使用的内镜再次消毒、终末漂洗、干燥后方可使用。近年来,国外研究证实具有干燥和提供受控环境功能的智能内镜储存柜有利于内镜安全储存[14-15]。研究相比于标准内镜储存柜(以下简称标准柜),国内智能内镜储存柜(以下简称智能柜)在干燥内镜管腔中的优势,为内镜安全储存提供基础数据。
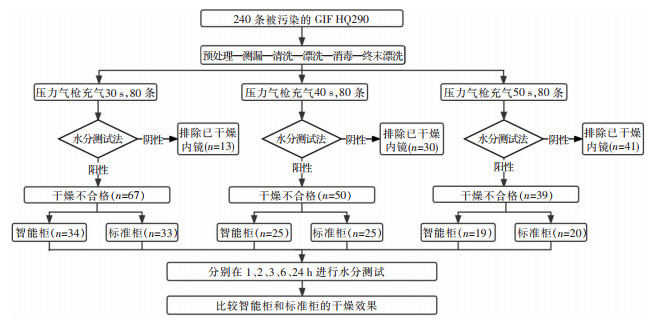
1 对象与方法 1.1 研究对象选择2021年6-10月某三级甲等医院消化内镜诊疗中心行普通胃镜检查所使用的胃镜(日本奥林巴斯,GIF HQ290)240条。该内镜插入部有效长度为1.03 m,钳子管道最小器械孔道直径为2.8 mm,送气量≥800 mL/min,全长1.35 m。
1.2 研究材料内镜清洗工作站(深圳柯丽尔)、压力气枪、智能柜(某品牌ESC-16SD)、标准柜(某品牌RX-1-典雅型)、水分指示纸(MICRO ESSENTIAL-Hydrion Humidicator Paper, 纽约布兰克林实验室)、带涂层一次性使用内镜活体取样钳(南京南微,可通过最小钳道2.8 mm,工作长度1.6 m)。
1.3 内镜再处理过程指定一名清洗消毒人员对拟研究的内镜进行再处理。再处理流程按照《软式内镜清洗消毒技术规范》(WS507-2016)规定的“预处理-测漏-清洗-漂洗-消毒-终末漂洗”进行。内镜离开患者体内后,立即用去生物膜多酶清洗剂(清洗剂与水的比例为1∶270)进行床旁预处理;手工清洗时采用同样配比浓度的去生物膜多酶清洗剂;清洗后采用自动清洗消毒机进行消毒,消毒剂采用0.22%过氧乙酸,消毒时间为5 min;终末漂洗使用的纯净水滤膜孔径为0.2 μm,时间为2 min。
1.4 干燥效果研究方法完成终末漂洗的胃镜进入干燥环节。本研究使用压力为0.5 Mpa的专用高压气枪,气枪可以利用高于大气压的压力使内镜外表面及管腔内的水滴气化或离开内镜。压缩泵向气枪提供纯净、干燥的压缩空气,此泵由专人定期维护,确保空气清洁。操作者每次操作前需提前确认气枪功能正常,采用消毒湿巾擦拭气枪口,避免交叉污染。操作时操作者首先将内镜外表面吹干,其次将气枪端口对准活检管道口,计时员说开始后按下按钮,30 s后,计时员说停止立即结束操作。水分测试需将卷状水分指示纸裁剪成12.5 mm×5 mm大小的纸片,操作员戴上无菌手套,将活检钳夹住水分指示纸,自活检口插入,在先端部看到取样钳头部后向回收。管腔的干燥效果判定取决于水分指示纸与内镜管腔接触后颜色的变化。水分指示纸充分接触过管腔后,若指示纸未变色,代表干燥合格;若指示纸由原来的紫色部分或全部变为粉红色,代表干燥不合格。操作过程及结果鉴别见图 1。由操作员和计时员共同判定水分测试的结果。根据测试结果排除干燥合格的内镜,将干燥不合格的内镜按1∶1比例随机分配至试验组、对照组。随机分组系统由计算机生成,并使用顺序编号,由研究员进行内镜分组及收集。试验组的内镜放入智能柜中,对照组的内镜放入普通柜中,二者均为垂直悬挂,分别在1、2、3、6、24 h再次进行水分测试。采用相同的方法比较40 s及50 s充气组的内镜放入储存柜后管腔的干燥效果。设计路线图见图 2。随机方案的设定与结果统计将由专业统计学人员进行操作,对操作者及统计学人员设盲。
 |
| 注:左图为操作现场;右图为测试结果,上方试纸代表干燥不合格,下方试纸代表干燥合格。 图 1 消化内镜干燥操作过程及结果鉴别图 Figure 1 Digestive endoscope drying process and identification of result |
 |
| 图 2 消化内镜干燥试验设计路线图 Figure 2 Design roadmap of digestive endoscope drying test |
应用SPSS 26.0软件对不同时间充气组各个时间点智能柜与标准柜中内镜的干燥情况进行χ2检验,若期望计数 < 5,则采取Fisher’s确切检验。同时进行单因素生存曲线比较(Kaplan-Meier法),统计检验采用双侧等效性检验,检验水准α=0.05。
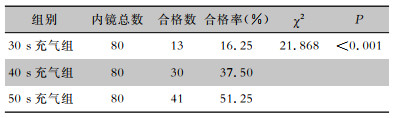
2 结果 2.1 不同充气时间干燥效果比较30 s、40 s、50 s充气组内镜管腔干燥的合格率比较,差异具有统计学意义(χ2值为21.868,P < 0.001),50 s充气组内镜管腔干燥合格率最高,30 s充气组内镜管腔干燥合格率最低。见表 1。
| 表 1 不同充气时间后的内镜管腔干燥效果对比 Table 1 Comparison of endoscopic lumen drying effect after different inflation times |
|
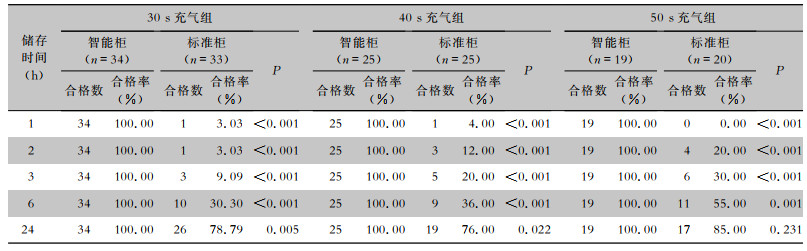
30 s、40 s、50 s充气组的内镜在放入储存柜1、2、3、6 h后,智能柜与标准柜的内镜管腔干燥合格率比较,差异均有统计学意义(均P < 0.05)。再处理后的内镜放入智能柜中1 h即可达到所有内镜管腔干燥。30 s、40 s充气组内镜放置24 h时,智能柜和标准柜内镜管腔干燥合格率比较,差异仍有统计学意义(均P < 0.05)。50 s充气组内镜放置24 h时,智能柜和标准柜内镜管腔干燥合格率比较,差异无统计学意义(P>0.05),见表 2。采用单因素生存曲线绘制智能柜和普通柜不同时间充气组在不同储存时间下内镜管腔干燥不合格率情况,见图 3。
| 表 2 智能柜和普通柜不同时间充气组内镜管腔干燥效果对比 Table 2 Comparison of endoscopic lumen drying effect between intelligent cabinet and common cabinet in different inflation time groups |
|
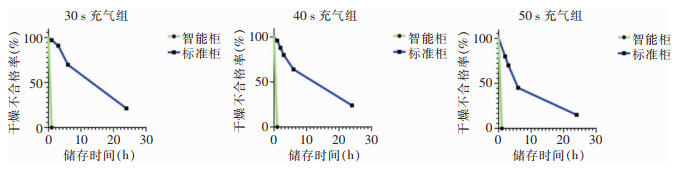 |
| 图 3 智能柜和普通柜不同时间充气组不同储存时间下内镜管腔干燥不合格情况 Figure 3 Unqualified status of endoscopic lumen drying of different inflation time groups under different storage time of intelligent cabinet and common cabinet |
面对新冠疫情的持续存在,许多指南及报道均要求在消化内镜感染控制中加强内镜干燥环节的管理[16-17]。要想实现内镜的完全干燥,研究称需要至少10 min的气枪干燥才能达到管腔完全干燥[10],但不论是从时间限制还是气枪数量配比来看,此要求在我国医疗机构都难以实现。Thaker等[18]研究表明,如果内镜没有实施干燥步骤或者干燥不合格,水分可以在内镜管腔中停留几天,为生物膜的形成提供足够的时间。且有多项证据表明,用于提高内镜医生视野清晰度的西甲硅油不利于内镜的清洗和干燥效果,其含有的糖分和增稠剂能为生物膜形成提供营养,增加生物膜形成的风险[19-20]。Ofstead等[21]调查美国3所大型医院发现,49%的内镜管腔内存在水分。Barakat等[22]利用管道镜对内镜进行检测后同样证实大量软式内镜管腔中存在水分,很多医疗机构干燥程序不合格。对江苏省106所内镜诊疗中心进行调查,结果显示江苏省95%以上的医疗机构采取气枪的方式对内镜管腔进行干燥,使用气枪干燥的医疗机构将管腔充气时间设置在30 s的占58.49%[23]。《软式内镜清洗消毒技术规范》(WS507-2016)要求干燥应利用压力气枪中的压缩空气向所有管道充气30 s及以上,至其完全干燥,但未给出具体的评价方法,简单的目测法往往难以正确评价管腔内部的干燥情况[24]。
本研究结果表明,智能柜在减少人工干燥时间的前提下,能达到理想的干燥效果。干燥不仅能够使细菌脱水、蛋白质变性和盐类浓缩,阻止细菌代谢和繁殖,还能阻止生物膜的生长[25-26]。本组试验结果显示,即使只执行规范要求的最低吹气时间30 s,在设置真空泵每小时工作15 min的情况下,内镜的管腔仍能够在放入储存柜1 h后实现内镜管腔的完全干燥。而标准柜若仅充气30 s,即使放置24 h仍有部分内镜管腔存在残留液滴。智能柜自动化干燥的特点不仅能够减少洗消员的工作量,还增加了内镜储存的安全性,为免除每日开始诊疗前的再次消毒提供了可能,有利于节约大量的人力、物力。在急诊等紧急而无法实现使用前再次消毒的情况下,使用智能柜可以使医护工作者拥有洁净的内镜,减少突发状况下内镜感染发生的可能。
标准柜为内镜提供储存空间,利用紫外线照射定期对柜子本身进行消毒,但无法提供持续干燥功能,空气质量、温湿度也无法得到控制。研究中使用的智能柜具有微粒空气过滤循环干燥系统,可以将过滤、消毒及加热后的空气送入储存区内,利用热交换将内镜的外表面进行干燥。而较难干燥成功的内镜管腔则使用内镜真空接口与内镜所有管腔进行相连,真空泵启动后可以降低内镜管腔中的真空度,将管腔中的水分汽化后排出,从而实现对内镜管道的干燥。此外,智能柜将保持柜内正压状态,恒定处于设置的温度与湿度,供应干燥高效洁净的压缩空气,让内镜储存区内的储存环境一直在受控环境中,从而保证了内镜较长时间的保存。同时其具备信息化可追溯性技术,可追溯存储的温度、时间、操作者等信息,有助于管理者进行内镜储存环节的管理。
英国标准学会(British Standards Institution)制定的《用于再处理后的不耐热内镜的受控环境存储柜》(BS EN16442:2015)[27]在对管腔干燥效果的评价中推荐使用水分指示纸。目测的方法不仅结果不可靠而且不易量化,狭长的管腔更是存在视觉盲区。水分指示纸十分灵敏,一项研究证实10 μL的水即可使本研究使用的水分指示纸发生变化[11]。通过比对卡,可以大致得出湿度范围。研究中使用取样钳夹住水分指示纸穿过活检管腔两遍,该结果相比传统地将水滴排出至先端处收集更具有科学性。由于本中心临床内镜轮转限制,尚未对肠镜、十二指肠镜等管腔直径大于2.8 mm的内镜进行探索,本研究内镜种类不够全面,需更多研究来验证智能柜干燥以及减少微生物生长风险的有效性。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
李兆申, 张菂. 消化内镜进入新时代[J]. 中华消化杂志, 2021, 41(6): 361-365. Li ZS, Zhang D. New era of digestive endoscopy[J]. Chinese Journal of Digestion, 2021, 41(6): 361-365. DOI:10.3760/cma.j.cn311367-20210218-00099 |
| [2] |
Petersen BT. Current state and future of infection prevention in endoscopy[J]. Gastrointest Endosc Clin N Am, 2021, 31(4): 625-640. DOI:10.1016/j.giec.2021.05.001 |
| [3] |
国家卫生和计划生育委员会. 软式内镜清洗消毒技术规范: WS 507-2016[S]. 北京: 中国标准出版社, 2017. National Health and Family Planning Commission. Regulation for cleaning and disinfection technique of flexible endoscope: WS 507-2016[S]. Beijing: Standards Press of China, 2017. |
| [4] |
Dirlam Langlay AM, Ofstead CL, Mueller NJ, et al. Reported gastrointestinal endoscope reprocessing lapses: the tip of the iceberg[J]. Am J Infect Control, 2013, 41(12): 1188-1194. DOI:10.1016/j.ajic.2013.04.022 |
| [5] |
李晔, 胡国庆. 临床使用软式内镜生物膜污染研究进展[J]. 中国消毒学杂志, 2021, 38(7): 542-545. Li Y, Hu GQ. Research progress on biofilm fouling of flexible endoscopes in clinical use[J]. Chinese Journal of Disinfection, 2021, 38(7): 542-545. |
| [6] |
Bhatt S, Mehta P, Chen C, et al. Efficacy of low-temperature plasma-activated gas disinfection against biofilm on contaminated GI endoscope channels[J]. Gastrointest Endosc, 2019, 89(1): 105-114. DOI:10.1016/j.gie.2018.08.009 |
| [7] |
Alfa MJ, Singh H. Impact of wet storage and other factors on biofilm formation and contamination of patient-ready endoscopes: a narrative review[J]. Gastrointest Endosc, 2020, 91(2): 236-247. DOI:10.1016/j.gie.2019.08.043 |
| [8] |
Kovaleva J. Endoscope drying and its pitfalls[J]. J Hosp Infect, 2017, 97(4): 319-328. DOI:10.1016/j.jhin.2017.07.012 |
| [9] |
Alfa MJ. Quality systems approach for endoscope reprocessing: you don't know what you don't know![J]. Gastrointest Endosc Clin N Am, 2020, 30(4): 693-709. DOI:10.1016/j.giec.2020.06.005 |
| [10] |
Cheung DY, Jang BI, Kim SW, et al. Multidisciplinary and multisociety practice guideline on reprocessing flexible gastrointestinal endoscopes and endoscopic accessories[J]. Clin Endosc, 2020, 53(3): 276-285. DOI:10.5946/ce.2020.106 |
| [11] |
王伟民, 马久红. 消化内镜安全储存的研究现状及进展[J]. 中国消毒学杂志, 2018, 35(9): 689-692. Wang WM, Ma JH. Research status and progress of safe sto-rage of digestive endoscope[J]. Chinese Journal of Disinfection, 2018, 35(9): 689-692. DOI:10.11726/j.issn.1001-7658.2018.09.017 |
| [12] |
Beilenhoff U, Neumann CS, Rey JF, et al. ESGE-ESGENA guideline: cleaning and disinfection in gastrointestinal endoscopy[J]. Endoscopy, 2008, 40(11): 939-957. DOI:10.1055/s-2008-1077722 |
| [13] |
Loyola M, Babb E, Bocian S, et al. Standards of infection prevention in reprocessing flexible gastrointestinal endoscopes[J]. Gastroenterol Nurs, 2020, 43(3): E142-E158. DOI:10.1097/SGA.0000000000000536 |
| [14] |
Grandval P, Hautefeuille G, Marchetti B, et al. Evaluation of a storage cabinet for heat-sensitive endoscopes in a clinical se-tting[J]. J Hosp Infect, 2013, 84(1): 71-76. DOI:10.1016/j.jhin.2013.01.013 |
| [15] |
Perumpail RB, Marya NB, McGinty BL, et al. Endoscope reprocessing: comparison of drying effectiveness and microbial levels with an automated drying and storage cabinet with forced filtered air and a standard storage cabinet[J]. Am J Infect Control, 2019, 47(9): 1083-1089. DOI:10.1016/j.ajic.2019.02.016 |
| [16] |
Gralnek IM, Hassan C, Beilenhoff U, et al. ESGE and ESGENA position statement on gastrointestinal endoscopy and the COVID -19 pandemic[J]. Endoscopy, 2020, 52(6): 483-490. DOI:10.1055/a-1155-6229 |
| [17] |
Chua T, Halim N, Reicher S. Recent advances in endoscope disinfection: where do we stand in the COVID era?[J]. Tech Innov Gastrointest Endosc, 2021, 23(2): 190-198. DOI:10.1016/j.tige.2020.10.001 |
| [18] |
Thaker AM, Kim S, Sedarat A, et al. Inspection of endoscope instrument channels after reprocessing using a prototype borescope[J]. Gastrointest Endosc, 2018, 88(4): 612-619. DOI:10.1016/j.gie.2018.04.2366 |
| [19] |
Ofstead CL, Hopkins KM, Eiland JE, et al. Widespread clinical use of simethicone, insoluble lubricants, and tissue glue during endoscopy: a call to action for infection preventionists[J]. Am J Infect Control, 2019, 47(6): 666-670. DOI:10.1016/j.ajic.2019.02.012 |
| [20] |
毕正琴, 李贤煌, 周梦娇, 等. 软式内镜干燥现状的研究进展[J]. 中国消毒学杂志, 2021, 38(11): 860-863. Bi ZQ, Li XH, Zhou MJ, et al. Research progress on the drying status of flexible endoscopes[J]. Chinese Journal of Di-sinfection, 2021, 38(11): 860-863. DOI:10.11726/j.issn.1001-7658.2021.11.018 |
| [21] |
Ofstead CL, Heymann OL, Quick MR, et al. Residual moisture and waterborne pathogens inside flexible endoscopes: evidence from a multisite study of endoscope drying effectiveness[J]. Am J Infect Control, 2018, 46(6): 689-696. DOI:10.1016/j.ajic.2018.03.002 |
| [22] |
Barakat MT, Girotra M, Huang RJ, et al. Scoping the scope: endoscopic evaluation of endoscope working channels with a new high-resolution inspection endoscope (with video)[J]. Gastrointest Endosc, 2018, 88(4): 601-611. DOI:10.1016/j.gie.2018.01.018 |
| [23] |
石雪平, 李雯, 谢甜芳, 等. 江苏省106所医疗机构消化内镜清洗质量问卷调查[J]. 中华医院感染学杂志, 2021, 31(21): 3356-3360. Shi XP, Li W, Xie TF, et al. Questionnaire survey of cleaning quality of digestive endoscopes in 106 medical institutions in Jiangsu province[J]. Chinese Journal of Nosocomiology, 2021, 31(21): 3356-3360. |
| [24] |
Nerandzic M, Antloga K, Litto C, et al. Efficacy of flexible endoscope drying using novel endoscope test articles that allow direct visualization of the internal channel systems[J]. Am J Infect Control, 2021, 49(5): 614-621. DOI:10.1016/j.ajic.2020.08.034 |
| [25] |
Tian HF, Sun J, Guo SN, et al. The effectiveness of drying on residual droplets, microorganisms, and biofilms in gastrointestinal endoscope reprocessing: a systematic review[J]. Gastroenterol Res Pract, 2021, 2021: 6615357. |
| [26] |
Bertotto MM, Gastón A, Sánchez Sarmiento G, et al. Effect of drying conditions on the quality of IRGA 424 rice[J]. J Sci Food Agric, 2019, 99(4): 1651-1659. DOI:10.1002/jsfa.9349 |
| [27] |
British Standards Institution. Controlled environment storage cabinet for processed thermolabile endoscopes: BS EN 16442: 2015[S]. UK: British Standards Limited, 2015.
|



