消化内镜的发明和临床应用是近代胃肠病学发展史上的重大突破。目前,消化内镜从初期的单纯诊断逐渐发展到融诊断与治疗于一体的微创介入技术。各种新型功能的消化内镜显著提高了消化系统疾病的诊疗水平[1-2]。内镜诊疗在我国发展迅速,2012年的一项研究[3]显示,我国超过1 000张床位的大型医院平均每年内镜诊疗量超过5 000人次。然而,近几年欧洲及美国陆续报道了因实施内镜逆行胰胆管造影术所导致的感染案例,软式内镜高水平消毒能否满足诊疗要求,是目前亟待解决的问题[4-5]。国内外权威机构陆续制定了软式内镜清洗与消毒指南,旨在进一步规范和完善消化内镜清洗与消毒流程及质量控制程序。然而,研究[4-6]发现,即使经过采用指南推荐的清洗与消毒流程严格处理后,消化内镜依然存在菌落数超标的现象,部分甚至引起严重的医院感染暴发事件。提示现有的清洗、消毒流程和质量控制程序依然不够完善,可能存在引起感染的风险[7-8]。据中国疾病预防控制中心一项调查[9]显示,我国十二指肠镜消毒后微生物学检测合格率仅为37%。由于内镜检查多为门诊操作,患者即使被感染也不易追溯,以及医院感染监测敏感性较低等因素,尽管目前我国尚未报道因内镜再处理不合格引起的医院感染暴发事件,但也应该提高警惕。本文从环境卫生学常规监测发现一起再处理后肠镜细菌菌落数超标事件,进一步对消化内镜再处理的各个环节进行逐一排查,查找原因,为避免软式内镜再处理不合格的情况提供依据。
1 资料与方法 1.1 资料来源2021年8月某院医院感染管理科对消化内镜中心进行的第3季度常规环境卫生学监测资料,监测对象包括清洗与消毒后的肠镜、使用中的消毒剂、内镜清洗纯化水、内镜清洗工作站气源喷枪喷出气体、气路管道内表面。
1.2 采样及检验方法 1.2.1 肠镜采样及实验室检测依据《医院消毒卫生标准》 GB 15982—2012的采样方法,采样部位为内镜内腔面。使用含有相应中和剂的采样液50 mL从待检测内镜活检口注入,从出口收集所有采样液,及时送检。取收集的洗脱液1.0 mL,加入直径9 cm无菌平皿中,倒入40~45℃熔化的营养琼脂15~20 mL,轻轻震荡混匀后待凝固;剩余洗脱液过滤浓缩,滤膜孔径大小为0.45 μm,采用无菌操作将滤膜取下贴于营养琼脂平板上。接种后平板于35℃恒温培养48 h后进行菌落计数。本季度常规监测共采集8条消化内镜,其中肠镜和胃镜各4条。
1.2.2 使用中消毒剂采样及实验室检测监测的消毒剂为邻苯二甲醛、过氧乙酸,依据GB 15982—2012的采样方法,用无菌注射器吸取1 mL内镜消毒剂,注入含9 mL相应中和剂试管中并及时送检。用无菌吸管吸取一定稀释比例的中和后混合液1.0 mL接种平皿,将冷至40~45℃的熔化营养琼脂培养基每皿倾注15~20 mL,35℃恒温箱培养72 h, 计数菌落数。
1.2.3 纯化水采样及实验室检测依据GB 15982—2012,取50 mL纯化水及时送检。取收集的洗脱液1.0 mL,加入直径9 cm无菌平皿,倒入溶化的40~45℃ R2A培养基15~20 mL,待凝固;剩余纯化水用0.45 μm滤膜过滤浓缩,将滤膜反贴于R2A平板上,20℃恒温培养168 h(7 d),进行菌落计数。
1.2.4 气源喷枪采样及实验室检测采用涂抹法及直接对培养皿喷气的方法。涂抹法:将喷枪拆卸,采用无菌棉拭子(生理盐水浸润)旋转涂抹喷枪的外表面和内部。剪去操作者手接触部分,将棉拭子置于10 mL生理盐水中,取1.0 mL加入直径9 cm无菌平皿,倒入溶化的40~45℃营养琼脂15~20 mL,35℃恒温培养48 h,进行菌落计数。喷气法:将气源喷枪空气喷出15 s,再将气源喷枪对准培养皿表面喷气15 s,将培养皿及时送检。
1.2.5 送气管道采样及实验室检测监测部位为管道内腔面,使用生理盐水50 mL从取下的送气管道一端注入,用100 mL无菌瓶从另一端收集所有采样液,及时送检。送气管道实验室检测方法参照内镜实验室检测方法。
1.2.6 空气过滤器采样及实验室检测监测部位为空气过滤器内表面,将空气过滤器拆卸,采用无菌棉拭子(生理盐水浸润)旋转涂抹空气过滤器内表面。剪去操作者手接触部分,将棉拭子置于10 mL生理盐水中,取1.0 mL加入直径9 cm无菌平皿,倒入溶化的40~45℃营养琼脂15~20 mL,35℃恒温培养48 h,进行菌落计数。
1.3 判断标准依据《医院消毒卫生标准》GB 15982—2012,消化内镜属于中度危险性医疗器材,消毒后内镜细菌总数应≤20 CFU/件(CFU/g或CFU/100 cm2),不得检出致病性微生物。使用中消毒剂应无菌生长。依据《生活饮用水标准》GB 5749—2006,纯化水中细菌总数应≤10 CFU/100 mL。
2 结果 2.1 环境卫生学监测样本合格情况结果发现,4条胃镜、2份纯化水、2份使用中消毒剂、3份环境物体表面和2份医务人员卫生手消毒标本监测结果均合格;而4条肠镜(2条为机器清洗,2条为人工清洗)可见大量细菌生长,染菌量分别为252、315、273、268 CFU/件,均检出放射根瘤菌、藤黄微球菌、少动鞘氨醇单胞菌。
2.2 原因分析医院感染专职人员及消化内镜中心负责人员对引起肠镜监测不合格的可能风险因素进行识别。该院消化内镜洗消中心采取胃镜、肠镜分开清洗与消毒工作模式,胃镜与肠镜采用独立清洗工作站及清洗消毒机,但清洗消毒工作人员、纯化水系统未分开,消毒剂与清洗液均采用同一品牌、同一批次产品。此次检查发现抽取的4条胃镜均合格,而4条肠镜均不合格,且检出细菌为环境中常见菌,初步判定肠镜清洗消毒不合格原因为内镜在清洗消毒过程中发生二次污染,尤其是肠镜清洗消毒设备故障可能是引起污染的最主要原因。
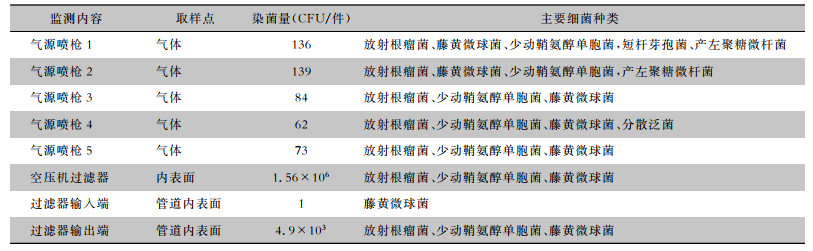
根据问题发生的可能性,邀请设备工程师对纯化水系统、肠镜清洗消毒机和肠镜组内镜清洗工作站进行严格排查。在对肠镜组内镜清洗工作站进行全面检查时,发现净化空气的过滤器内积水严重,遂对肠镜组内镜清洗工作站5支气源喷枪喷出的气体进行生物学检测,均检出大量细菌,且以放射根瘤菌、藤黄微球菌和少动鞘氨醇单胞菌为主。进一步对空气过滤器内部及进出过滤器的管道内部进行生物学检测,结果显示空气过滤器内部及过滤器输出端内部也存在大量细菌,同样以放射根瘤菌、藤黄微球菌和少动鞘氨醇单胞菌为主。而空气过滤器输入端细菌数仅1 CFU。空压机及空气过滤器示意图见图 1。气路更换前肠镜清洗工作站气体及气路管道染菌量检测结果见表 1。
 |
| 注:A为空压机;B为空气过滤器;C为气源喷枪。 图 1 空压机及空气过滤器示意图 Figure 1 Schematic diagram of air compressor and air filter |
| 表 1 气路更换前肠镜清洗工作站气体及气路管道染菌量检测结果 Table 1 Detection results of bacterial contamination in air and air line of enteroscope cleaning workstation before replacement of air line |
|
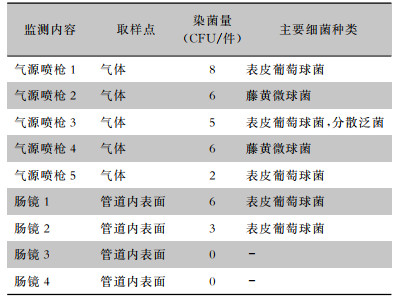
消化内镜中心负责人第一时间通知内镜清洗工作站工程师,对空压机、空气过滤器及气路管道予以更换。对更换后气源喷枪气体及肠镜染菌量重新检测。结果显示,气源喷枪气体中细菌数量显著减少。对4条不合格的肠镜重新清洗、消毒、干燥,并进行染菌量检测,结果显示均合格。见表 2。
| 表 2 气路更换后肠镜清洗工作站气体及气路管道染菌量检测结果 Table 2 Detection results of bacterial contamination in air and air line of enteroscope cleaning workstation after replacement of air line |
|
内镜污染事件屡见不鲜。一项由Seoane-Vazquez等[10]报道的Meta分析显示,在1974—2004年的三十年间,美国共有10 989例患者暴露于污染的内镜操作中,其中740例患者因此感染。自2015年起,美国数家医疗机构陆续发生由内镜污染引起的“超级细菌”医院感染暴发事件。国内虽然尚无报道因内镜污染引起的感染事件,但仍然需引起注意。
为了提高消化内镜的清洗消毒质量,降低感染暴露的风险,我国在2004年制定了内镜清洗与消毒技术操作规范,2016年进行更新。然而临床实践中仍不时发现消化内镜再处理后菌落数超标的现象,提示现有清洗、消毒流程和质量控制程序不够完善,存在引起感染的风险[11-13]。造成此类现象发生的原因很多,例如:①清洗与消毒后,受到冲洗水的污染,出现细菌数超标的情况;②清洗与消毒后,软式内镜贮存不当引发二次污染的发生;③清洗设备管路复杂隐蔽,缺乏有效消毒措施,导致消毒后内镜发生二次污染等。
近几年兴起的内镜清洗工作站均配备有气源喷枪,用于消毒环节结束后管道内残余消毒剂的清除,以及终末漂洗后内镜的内部干燥。但目前尚未有关于气路气体污染引起消毒后内镜二次污染的报道。本次监测发现抽样检查的4条肠镜染菌量均严重超标,其原因是由于空气过滤器导致的压缩空气的严重污染。空气进入空气压缩机,经过压缩、冷却、干燥后储存在储气罐中,当启动气源喷枪时,空气从储气罐中通过空气过滤器,过滤后的洁净空气再通过气路管道进入各个气源喷枪。该院内镜清洗消毒中心所使用的空气过滤器的滤芯主要由超细玻璃纤维纸构成,其孔径大小为0.1 μm,起泡点为0.13 Mpa,理论上可过滤绝大多数细菌(0.5~5 μm)。湿度能够提高空气过滤器的过滤效率,同时能使气压差在原来起泡点的基础上增加约90 Pa,但当气压突破起泡点压差时,气体将大量突破已经湿润的滤膜[14]。本研究中,由于空压机故障,经过压缩的湿润空气无法有效干燥,致使使用中的过滤器内部积水严重,导致环境中常见细菌定植在滤芯表面,此时的滤芯非但不能起到阻隔细菌的作用,反而成为细菌繁殖的温床,空压机的巨大压力差(0.2~0.8 Mpa)使得含有大量细菌的空气从滤芯表面源源不断输送到气源喷枪,最终引起肠镜管腔内部的二次污染。放射根瘤菌、少动鞘氨醇单胞菌以及藤黄微球菌都是环境中常见的条件致病菌,一般不致病,但当细菌数量过多,且人体免疫力低下时易造成机会性感染[15-17]。进行胃肠镜检查的患者虽多为门诊体检患者,但其中也有部分免疫力低下患者,因此应当引起重视。
内镜清洗工作站的设置是为了更加规范及方便地对软/硬式内镜进行使用后再处理,但其内部水路及气路管道复杂,存在微生物污染风险。我国于2016年颁布的《内镜清洗工作站》YY 0992—2016要求气源压力范围在0.2~0.8 Mpa,空气过滤器能过滤直径≥0.3 μm的微粒,对消毒后漂洗用纯化水要求微生物<10 CFU/100 mL,但该规范未对压缩空气的染菌量限值作出规定。为降低软式内镜再处理后的细菌污染风险,提高软式内镜再处理质量,针对本研究中发现的问题,提出以下3点改进措施:①请工程师定期对空压机进行维护;②增加空气过滤器滤芯更换频次;③医院感染管理科工作人员将气源喷枪气体纳入监测范围,定期监测,以便及时发现气源喷枪污染。
本研究确定引起肠镜二次污染的原因是用于终末干燥的压缩气体污染所致。目前国内外尚无关于压缩气体引起软式内镜二次污染的报道,也无相关技术指南提出针对气路的定期监测和维护的要求。因此,尽快制定医用压缩空气统一、全面的指导性规范,将气路维护及生物学监测纳入相应规范中,将有助于提高对压缩空气的管理,减少由此引起的医院感染,进一步提高医疗质量。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Hervé RC. Endoscopy in the twenty-first century: minimally invasive state-of-the-art medical technology or a future main vector of hospital-acquired infections?[J]. J Hosp Infect, 2017, 97(4): 329-330. DOI:10.1016/j.jhin.2017.07.030 |
| [2] |
张慧, 薛艳, 周丽雅, 等. 北京某三级甲等医院35年间主要上消化道疾病及幽门螺杆菌感染的演变[J]. 中华内科杂志, 2016, 55(6): 440-444. Zhang H, Xue Y, Zhou LY, et al. The changes of main upper gastrointestinal diseases and Helicobacter pylori infection status in the past thirty five years[J]. Chinese Journal of Internal Medicine, 2016, 55(6): 440-444. DOI:10.3760/cma.j.issn.0578-1426.2016.06.008 |
| [3] |
Zhang XL, Lu ZS, Tang P, et al. Current application situation of gastrointestinal endoscopy in China[J]. World J Gastroenterol, 2013, 19(19): 2950-2955. DOI:10.3748/wjg.v19.i19.2950 |
| [4] |
Rauwers AW, Voor In't Holt AF, Buijs JG, et al. High prevalence rate of digestive tract bacteria in duodenoscopes: a nationwide study[J]. Gut, 2018, 67(9): 1637-1645. DOI:10.1136/gutjnl-2017-315082 |
| [5] |
Kola A, Piening B, Pape UF, et al. An outbreak of carbape-nem-resistant OXA-48-producing Klebsiella pneumonia asso-ciated to duodenoscopy[J]. Antimicrob Resist Infect Control, 2015, 4: 8. DOI:10.1186/s13756-015-0049-4 |
| [6] |
Day LW, Kwok K, Visrodia K, et al. American Society for Gastrointestinal Endoscopy Infection Control Summit: updates, challenges, and the future of infection control in GI endoscopy[J]. Gastrointest Endosc, 2021, 93(1): 1-10. DOI:10.1016/j.gie.2020.06.024 |
| [7] |
何荣攀, 李贤煌, 毕正琴, 等. 37所医院消化内镜超声探头清洗消毒现况调查[J]. 中国感染控制杂志, 2020, 19(12): 1059-1063. He RP, Li XH, Bi ZQ, et al. Cleaning and disinfection of ultrasound probes of digestive endoscopes in 37 hospitals[J]. Chinese Journal of Infection Control, 2020, 19(12): 1059-1063. DOI:10.12138/j.issn.1671-9638.20206524 |
| [8] |
张丽华, 陈秀荣, 尹晓华, 等. 消化内镜医院感染相关因素及不同清洗消毒方法对灭菌效果的影响[J]. 中华医院感染学杂志, 2017, 27(24): 5715-5718. Zhang LH, Chen XR, Yin XH, et al. Risk factors of endoscopic nosocomial infections and the effect of different cleaning and disinfection methods on sterilization[J]. Chinese Journal of Nosocomiology, 2017, 27(24): 5715-5718. |
| [9] |
马慧, 张婕, 李涛, 等. 十二指肠镜消毒后微生物污染调查[J]. 中华医院感染学杂志, 2017, 27(12): 2853-2856. Ma H, Zhang J, Li T, et al. Investigation on bacterial contamination of disinfected duodenoscopes[J]. Chinese Journal of Nosocomiology, 2017, 27(12): 2853-2856. |
| [10] |
Seoane-Vazquez E, Rodriguez-Monguio R, Visaria J, et al. Exogenous endoscopy-related infections, pseudo-infections, and toxic reactions: clinical and economic burden[J]. Curr Med Res Opin, 2006, 22(10): 2007-2021. DOI:10.1185/030079906X121048 |
| [11] |
Walker JT, Bak A, Marsden G, et al. Final rinse water quality for flexible endoscopy to minimize the risk of post-endosco-pic infection. Report from healthcare infection society working party[J]. J Hosp Infect, 2022, 124: 79-96. DOI:10.1016/j.jhin.2022.02.022 |
| [12] |
刘文龙, 田贺峰, 朱炫瑞, 等. 软式消化内镜干燥方法的研究进展[J]. 中国感染控制杂志, 2022, 21(6): 604-609. Liu WL, Tian HF, Zhu XR, et al. Research progress on drying of flexible digestive endoscope[J]. Chinese Journal of Infection Control, 2022, 21(6): 604-609. |
| [13] |
Pasquale L, Maurano A, Cengia G, et al. Infection prevention in endoscopy practice: comparative evaluation of re-usable vs single-use endoscopic valves[J]. Infect Prev Pract, 2021, 3(2): 100123. DOI:10.1016/j.infpip.2021.100123 |
| [14] |
Xu B, Yu X, Wu Y, et al. Experimental investigation of air pressure affecting filtration performance of fibrous filter sheet[J]. Environ Technol, 2017, 38(5): 558-565. DOI:10.1080/09593330.2016.1202328 |
| [15] |
Bavaro DF, Mariani MF, Stea ED, et al. Sphingomonas paucimobilis outbreak in a dialysis room: case report and litera-ture review of an emerging healthcare associated infection[J]. Am J Infect Control, 2020, 48(10): 1267-1269. DOI:10.1016/j.ajic.2020.01.018 |
| [16] |
Mutlu M, Bayramoglu G, Yilmaz G, et al. Outbreak of Sphingomonas paucimobilis septicemia in a neonatal intensive care unit[J]. Indian Pediatr, 2011, 48(9): 723-725. DOI:10.1007/s13312-011-0114-x |
| [17] |
Erol Cipe F, Doǧu F, Sucuoǧlu D, et al. Asymptomatic catheter related Rhizobium radiobacter infection in a haploidentical hemapoetic stem cell recipient[J]. J Infect Dev Ctries, 2010, 4(8): 530-532. |



