惠普尔养障体(Tropheryma whipplei, TW)是革兰阳性杆菌,为条件致病菌,传播途径一般为粪-口途径,引起的疾病称惠普尔病,可累及胃肠道、骨关节、神经系统、心、肺、眼部等全身多个系统器官。TW肺炎是TW感染所致的肺炎,相对罕见,常见于接触污水、免疫缺陷患者,但TW肺炎临床症状无特异性,采用传统病原菌培养法难以检测,在临床上较易误诊。本文报告一例通过宏基因组二代测序(mNGS)检测确诊并被成功救治的TW合并耶氏肺孢子菌感染的获得性免疫缺陷综合征重症肺炎病例。
1 病史及入院检查患者女性,32岁,汉族,超市收银员,因“间断咳嗽、咳痰2月余,胸闷气短4 d”于2022年9月25日入我科呼吸重症监护病房(RICU),曾在社区医院输液治疗1周,具体不详,效果欠佳。伴乏力、纳差,偶有腹泻,无发热、畏寒、恶心、呕吐、便血、心悸等不适。既往体健。
入院体格检查:体温36.7℃,呼吸频率38次/min,心率108次/min,血压102/66 mmHg,氧饱和度83%,消瘦,精神差,双侧瞳孔等大等圆,直径3 mm,对光反射灵敏,口唇轻度紫绀,全身皮肤未见出血点及瘀斑异常改变。颈部及锁骨上淋巴结无肿大。双肺呼吸音稍粗,可闻及散在湿性啰音。腹软,无压痛及反跳痛,四肢肌张力正常,生理反射存在,病理反射未引出。双下肢无水肿。
入院实验室检查:白细胞计数8.12×109/L,红细胞计数2.90×1012/L,血红蛋白71 g/L,血小板计数310.0×109/L,中性粒细胞绝对值6.69×109/L,淋巴细胞绝对值0.8×109/L,中性粒细胞百分比82.4%,淋巴细胞百分比9.4%,等位基因特异的寡核苷酸(ASO)179.00 IU/mL,IgA 660.00 mg/dL,IgG 2 140.00 mg/dL;血气分析为氧分压61 mmHg,氧饱和度89%,二氧化碳分压29.60 mmHg,pH 7.46;降钙素原0.29 ng/mL,白细胞介素-6(IL-6)15.2 pg,血清淀粉样蛋白A(SAA)265.5 mg/L;红细胞沉降率(ESR)70 mm/h;新型冠状病毒、呼吸道病毒九项、乙型肝炎病毒及丙型肝炎病毒检测均为阴性,肝肾功能、电解质、凝血功能、风湿免疫指标正常,痰涂片、培养未见致病菌。
入院影像学检查:胸部CT显示双肺弥漫性多发磨玻璃影,见图 1。
 |
| 图 1 患者入院时肺部CT结果 Figure 1 Pulmonary CT results of patient at admission |
入院诊断:重症肺炎,Ⅰ型呼吸衰竭,耶氏肺孢子菌肺炎?中度贫血。予以经鼻高流量湿化氧疗(HFNC)呼吸支持(氧浓度71%,流量55 L/min),抗感染治疗[阿莫西林/克拉维酸钾1.8 g,q8h;莫西沙星0.4 g,qd;复方磺胺甲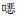
更正诊断:重症肺炎,Ⅰ型呼吸衰竭,TW肺炎,肺孢子菌肺炎,HIV感染,中度贫血。治疗方案调整为头孢曲松(2.0 g,q12h)、青霉素钠(800万U,q12h)、卡泊芬净(50 mg,qd;首剂75 mg,qd)、SMZ(400 mg/80 mg,2片,tid)抗感染;1周后患者急性呼吸窘迫综合征(ARDS)症状不能缓解,血气分析氧饱和度降低至80%。10月1日HIV-Ab阳性,湖北省疾病预防控制中心复核HIV-Ab阳性,10月2日淋巴细胞免疫分析显示CD4+淋巴细胞占比10.01%,10月3日胸部CT显示双肺磨玻璃影较9月25日进展,见图 2。
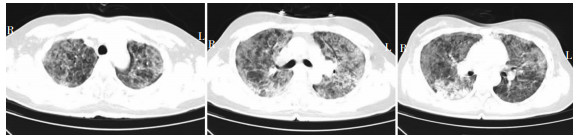 |
| 图 2 患者10月3日肺部CT结果 Figure 2 Pulmonary CT results of patient on October 3 |
10月4日进一步调整治疗方案:美罗培南(1.0 g,q8h)、卡泊芬净(50 mg,qd)、SMZ(400 mg/80 mg,2片,tid)治疗1周;患者呼吸窘迫症状逐渐缓解,氧饱和度回升至95%。10月14日肺部CT显示双肺感染较前明显好转,见图 3。患者于2022年10月19日康复出院,脱氧条件下血氧饱和度98%,院外继续口服SMZ(400 mg/80 mg,2片,tid)。
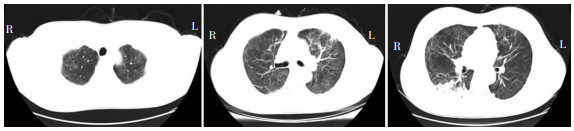 |
| 图 3 患者10月14日肺部CT结果 Figure 3 Pulmonary CT results of patient on October 14 |
TW是革兰阳性杆菌,为需氧菌,大小为(0.25~0.5)μm×(1.5~2.5)μm[1]。TW引起的疾病称惠普尔病,较为罕见,可累及胃肠道、骨关节、神经系统、心、肺、眼部等全身多个系统、器官,典型的临床表现为关节炎及各种消化道症状,如腹泻、吸收不良和体重下降等,仅13%~14%的病例出现呼吸系统表现[2]。
TW肺炎常见的临床表现有慢性咳嗽、呼吸困难和胸膜炎性胸痛[3]。Zhang等[4]总结了20例TW肺炎,最常见的临床症状为咳嗽(11例)和呼吸困难(10例),其次为咳痰(3例)、胸痛(3例)和咯血(1例),另外还有2例患者未表现出明显的呼吸系统症状。TW肺炎胸部影像学无特异性,最常见的胸部影像学表现为结节性改变,其次是间质改变和斑片状浸润[4]。本例中的患者表现为咳嗽和呼吸困难症状,双肺弥漫大片磨玻璃阴影。
TW检测主要是通过聚合酶链反应(PCR)、活体组织免疫组织化学和PAS染色、电子显微镜鉴定等特殊手段,活体组织免疫组织化学和PAS染色需进行胃肠道、骨关节、心脏瓣膜、淋巴结等活检,鲜有报道进行肺组织活检;电子显微镜技术大多数医院无法开展,其培养则需通过人巨噬细胞和成纤维细胞培养技术且检测周期长达30 d[5-6];除PCR外,上述手段在临床往往难以实现。但由于TW较为罕见和PCR检测的局限性,在标本菌量低、同一菌属不同菌种导致引物设计不合理时,会引起漏诊[7]。相比上述TW检测手段,mNGS能快速准确的明确病原微生物,在常规传染病检测结果回报之前,结合临床表现先人一步精准诊断,及时干预,治疗关口前移,明显改善预后。
本例患者临床表现为咳嗽和呼吸困难症状,胸部CT呈现双肺大面积磨玻璃样阴影,血气分析结果提示Ⅰ型呼吸衰竭。根据其临床表现及胸部影像学结果,常易考虑肺孢子菌或病毒合并细菌感染。考虑到患者呼吸窘迫症状较重,急需得到明确的病原学结果来指导治疗,因而立即在HFNC呼吸支持下行支气管镜支气管BALF mNGS检测,结果提示TW、耶氏肺孢子菌、HIV阳性。根据病原学结果,查阅相关文献,调整治疗方案为头孢曲松(2.0 g,q12h)、青霉素钠(800万U,q12h)、卡泊芬净(50 mg,qd)、SMZ(400 mg/80 mg,2片,tid)[8-9],但患者ARDS症状不能缓解。考虑TW不同菌种对头孢曲松、青霉素不敏感的可能,更换抗感染方案为美罗培南(1.0 g,q8h)、卡泊芬净(50 mg,qd)、SMZ(400 mg/80 mg,2片,tid)抗感染[9],患者1周内症状明显好转,胸部影像学及血氧明显好转。而更换抗感染方案后患者肺部感染迅速好转,进一步证实患者为TW及肺孢子菌混合感染。
在一些其他的研究中,同样观测到TW引起急性肺炎。Yan等[10]报道了1例28岁的男性HIV感染患者,临床表现为发热、咳嗽、呼吸困难等症状,取患者BALF标本行mNGS,最终诊断为肺孢子菌与TW混合感染,予该患者SMZ抗感染后见效缓慢,加用美罗培南1周后,患者症状明显改善。Guo等[11]通过纳米孔测序在3例间质性肺病合并肺部感染患者BALF中发现TW。Bousbia等[12]通过qPCR发现在一些入住重症监护病房(ICU)的免疫功能低下的肺炎患者中,TW是唯一的病原体。Fenollar等[13]的研究表明TW可能是社区获得性肺炎的病原体之一,患者吸入含有TW的飞沫可导致吸入性肺炎[12]。
作为一种缺陷型细菌,TW三羧酸循环途径基因完全缺失,生长增殖所需要的氨基酸等营养成份必须由宿主提供,是一种共生菌,患者在免疫受损时易感[14]。研究[15-16]表明,与HIV阴性受试者相比,HIV阳性受试者中TW的感染率及标本中的TW丰度更高。此外,Lozupone等[17]的研究还表明,行抗逆转录病毒治疗的HIV阳性患者其肺部TW的丰度显著降低。本病例患者为HIV感染女性患者,其CD4+T淋巴细胞数显著降低,免疫功能严重受损,为TW的易感人群。
综上分析,TW肺部感染发病率较低,临床表现多样,胸部影像学相对无特异性,是一种相对难以诊断的疾病,对于HIV感染患者,医生应保持足够的警惕。对于严重感染或未知少见病原体,mNGS能快速、灵敏获得病原体,常显著优于微生物培养,特别是免疫力低下患者的重症感染,能早期诊断,精准治疗。本文中根据mNGS结果不断调整抗菌治疗方案及抗炎治疗,最终使患者转危为安,体现了疑难危重肺部感染疾病临床思维的重要性。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Relman DA, Schmidt TM, MacDermott RP, et al. Identification of the uncultured bacillus of Whipple's disease[J]. N Engl J Med, 1992, 327(5): 293-301. DOI:10.1056/NEJM199207303270501 |
| [2] |
Marth T, Moos V, Müller C, et al. Tropheryma whipplei infection and Whipple's disease[J]. Lancet Infect Dis, 2016, 16(3): e13-e22. DOI:10.1016/S1473-3099(15)00537-X |
| [3] |
程燕, 宁永忠. 惠普尔养障体导致急性肺炎的探讨[J]. 中华检验医学杂志, 2021, 44(11): 1090-1093. Cheng Y, Ning YZ. Tropheryma whipplei as the cause of acute pneumonia[J]. Chinese Journal of Laboratory Medicine, 2021, 44(11): 1090-1093. |
| [4] |
Zhang WM, Xu L. Pulmonary parenchymal involvement caused by Tropheryma whipplei[J]. Open Med (Wars), 2021, 16(1): 843-846. DOI:10.1515/med-2021-0297 |
| [5] |
Boumaza A, Ben Azzouz E, Arrindell J, et al. Whipple's di-sease and Tropheryma whipplei infections: from bench to bedside[J]. Lancet Infect Dis, 2022, 22(10): e280-e291. DOI:10.1016/S1473-3099(22)00128-1 |
| [6] |
Raoult D, Birg ML, La Scola B, et al. Cultivation of the baci-llus of Whipple's disease[J]. N Engl J Med, 2000, 342(9): 620-625. DOI:10.1056/NEJM200003023420903 |
| [7] |
Lin MM, Wang KQ, Qiu LD, et al. Tropheryma whipplei detection by metagenomic next-generation sequencing in bronchoalveolar lavage fluid: a cross-sectional study[J]. Front Cell Infect Microbiol, 2022, 12: 961297. DOI:10.3389/fcimb.2022.961297 |
| [8] |
Lagier JC, Raoult D. Whipple's disease and Tropheryma whipplei infections: when to suspect them and how to diagnose and treat them[J]. Curr Opin Infect Dis, 2018, 31(6): 463-470. DOI:10.1097/QCO.0000000000000489 |
| [9] |
Lagier JC, Fenollar F, Lepidi H, et al. Treatment of classic Whipple's disease: from in vitro results to clinical outcome[J]. J Antimicrob Chemother, 2014, 69(1): 219-227. DOI:10.1093/jac/dkt310 |
| [10] |
Yan J, Zhang BH, Zhang ZD, et al. Case report: Tropheryma whipplei hide in an AIDS patient with Pneumocystis pneumonia[J]. Front Public Health, 2021, 9: 663093. DOI:10.3389/fpubh.2021.663093 |
| [11] |
Guo YF, Li LJ, Li ZZ, et al. Tropheryma whipplei detection by nanopore sequencing in patients with interstitial lung di-sease[J]. Front Microbiol, 2021, 12: 760696. DOI:10.3389/fmicb.2021.760696 |
| [12] |
Bousbia S, Papazian L, Auffray JP, et al. Tropheryma whipplei in patients with pneumonia[J]. Emerg Infect Dis, 2010, 16(2): 258-263. DOI:10.3201/eid1602.090610 |
| [13] |
Fenollar F, Ponge T, La Scola B, et al. First isolation of Tropheryma whipplei from bronchoalveolar fluid and clinical implications[J]. J Infect, 2012, 65(3): 275-278. DOI:10.1016/j.jinf.2011.11.026 |
| [14] |
Bentley SD, Maiwald M, Murphy LD, et al. Sequencing and analysis of the genome of the Whipple's disease bacterium Tropheryma whipplei[J]. Lancet, 2003, 361(9358): 637-644. DOI:10.1016/S0140-6736(03)12597-4 |
| [15] |
García-álvarez L, Pérez-Matute P, Blanco JR, et al. High prevalence of asymptomatic carriers of Tropheryma whipplei in different populations from the North of Spain[J]. Enferm Infecc Microbiol Clin, 2016, 34(6): 340-345. DOI:10.1016/j.eimc.2015.09.006 |
| [16] |
Eberhardt KA, Sarfo FS, Klupp EM, et al. Intestinal colonization with Tropheryma whipplei-clinical and immunological implications for HIV positive adults in Ghana[J]. Microorga-nisms, 2021, 9(8): 1781. DOI:10.3390/microorganisms9081781 |
| [17] |
Lozupone C, Cota-Gomez A, Palmer BE, et al. Widespread colonization of the lung by Tropheryma whipplei in HIV infection[J]. Am J Respir Crit Care Med, 2013, 187(10): 1110-1117. DOI:10.1164/rccm.201211-2145OC |



