2. 安徽省铜陵市人民医院院感科, 安徽 铜陵 244000
2. Department of Healthcare-associated Infection Management, Anhui Tong-ling People's Hospital, Tongling 244000, China
耳念珠菌是近些年逐渐被大家认识的一种酵母菌,因其对多种抗真菌药物耐药,被人们称为“超级真菌”。2009年首次从日本1例患者的外耳道分泌物中分离出,故而得名“耳念珠菌”,同年在其他患者的血液中分离出3株耳念珠菌[1]。2018年,在北京大学人民医院1例肾病综合征患者的肺泡灌洗液中检测出耳念珠菌,报道了我国首例“耳念珠菌”感染病例,但在该患者其他部位及周围环境中未检出[2]。近年来,耳念珠菌在全球30多个国家有报道,美国疾病控制和预防中心(CDC)的数据显示,除定植菌外,确诊或疑似病例从2018年的329例增加到2021年的1 012例。目前,耳念珠菌的起源尚未阐明,有学者推测与全球变暖有关,如鸟类等可能将真菌传播到城市地区,最终感染人类[3]。2022年6月某院重症医学科(ICU)1例长期住院患者出现高热,通过基质辅助激光解吸电离飞行时间质谱技术,在其外周血及导管尖标本中检出耳念珠菌,同时笔者将此菌株送检至合肥金域医学检验实验室,通过使用二代基因测序技术,进一步确定为耳念珠菌。在确认发生耳念珠菌败血症医院感染后,立即对病区整体进行主动筛查,并积极采取相关防控措施,使此次医院感染在短时间内得到有效控制。因目前国内关于耳念珠菌感染病例报道较少,本文总结和分析耳念珠菌感染患者、定植患者及周围环境监测的资料,以提高大家对耳念珠菌的认识,便于后期在临床工作中早发现、早处理。
1 材料与方法 1.1 样本采集2022年6月6日该院ICU 1例长期住院患者(章某)外周血及导管尖标本检出耳念珠菌,之后每间隔一周对病区内所有患者的体表(腹股沟、腋下、口腔、鼻腔、肛门)、病区环境(床单、输液泵、监护仪、呼吸机、吊塔、电脑、水龙头、门把手、治疗车、床头柜、工作台面)、医护人员手等使用棉拭子进行多次采样。采样后迅速将标本接种至沙保弱培养基,常温下送检时间<4 h。采集方法依据《医院感染预防与控制标准操作流程》,被采集物体表面积<100 cm2时,应取全部表面;被采集物体表面积>100 cm2时,采样应取100 cm2;门把手等小型物体采用棉拭子直接涂抹物体全部表面。
1.2 鉴定方法对所有采集的标本进行培养。培养方法:采样当天,将采样管中加入等体积(1 mL)沙保弱培养基,每管加入亚胺培南、万古霉素各两片,37℃孵育过夜;次日将培养后液体注入塑料离心管中离心,将沉淀接种于沙保弱和血平板中过夜;第三天采用基质辅助激光解吸电离飞行时间质谱技术进行分析鉴定。
1.3 医院感染防控措施根据院感科指导意见及相关文献推荐,共同制定以下防控措施[4-5]:(1)主动筛查首次检出耳念珠菌前一周内转出的全部患者。(2)感染患者使用卡伯芬净联合伏立康唑抗感染治疗。(3)停止接收新入或转入患者,同时严格限制患者转出病房。连续2次筛查结果阴性的患者,待病情好转后方可转至普通病房,但需单间隔离治疗至出院。(4)将感染患者由万级层流病房转移至单间负压病房隔离,将定植患者和未筛查出耳念珠菌患者在万级层流病房分别进行区域隔离。(5)病房内将所有住院患者按未筛查出、定植、感染顺序使用硫磺皂进行多次温水冲浴,同时每日定期使用2%洗必泰擦浴患者身体,腹股沟及腋下为重点部位。(6)一旦患者离开环境,应进行终末消毒,先清洁后消毒所有患者及医务人员手可能接触到的地方,消毒剂使用有效氯1 000 mg/L的次氯酸钠。(7)对于转出的定植者和筛查阴性患者,均执行终末消毒,包括冲浴后使用2%洗必泰擦洗等。(8)废物和织物的处理,使用红色垃圾袋收集,注意合理包装,避免废物和织物污染环境。(9)机器设备消毒,每日2次使用有效氯1 000 mg/L的次氯酸钠消毒。
2 结果 2.1 患者耳念珠菌检出情况 2.1.1 第一次主动筛查对14例在院患者的腹股沟、腋下、口腔、鼻腔、肛门进行采样,其中8例患者共检出耳念珠菌9株,见表 1。对首次检出耳念珠菌前一周内转出ICU的3例患者进行主动筛查,均未检出耳念珠菌。
| 表 1 患者不同采样部位第一次主动筛查检出耳念珠菌情况 Table 1 The first active screening of C. auris at different sampling sites of patients |
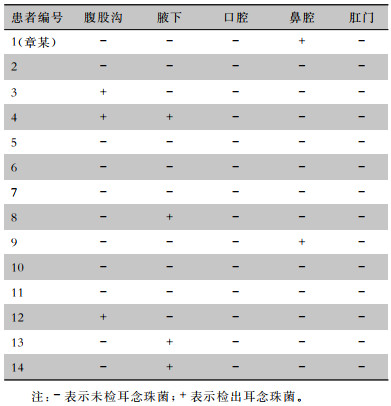
|
分别对13例在院患者的腹股沟、腋下、口腔、鼻腔、肛门进行采样,共检出耳念珠菌2株,分别来源于2例患者的腹股沟、鼻腔。见表 2。
| 表 2 患者不同采样部位第二次主动筛查检出耳念珠菌情况 Table 2 The second active screening of C. auris at different sampling sites of patients |
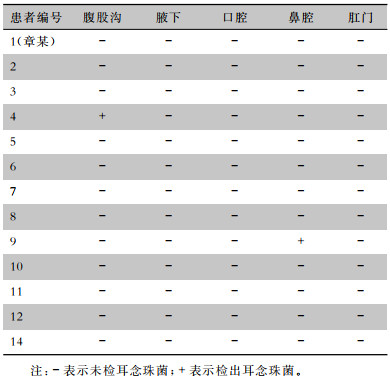
|
分别对8例在院患者的腹股沟、腋下、口腔、鼻腔、肛门进行采样,仅在1例患者的腹股沟和腋下检出耳念珠菌,余患者筛查结果均为阴性,见表 3。
| 表 3 患者不同采样部位第三次主动筛查检出耳念珠菌情况 Table 3 The third active screening of C. auris at different sampling sites of patients |
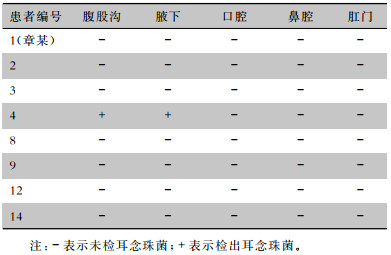
|
第一次主动筛查采集环境标本80份,分别在地面、医疗设备检出耳念珠菌6株。第二次和第三次主动筛查分别采集环境标本50、20份,均未检出耳念珠菌。
2.3 综合效果采取积极防控措施,14例在院患者仅1例发生医院感染,经积极抢救无效,16 d后患者死亡,其余患者因无发热,无感染学指标升高等临床表现,故确定为耳念珠菌定植病例,经积极采取防控措施后期均去定植,但其中1例患者定植时间较长,连续3次筛查均检出,定植时间超过3周,在第四次及第五次主动筛查中未再检出耳念珠菌。
3 讨论目前耳念珠菌感染的主要形式为侵袭性感染,病死率较高,主要通过血流、胃肠道及呼吸道感染[6],具有糖尿病、高血压、尿毒症、艾滋病等基础疾病或长期卧床免疫功能相对低下的患者更易发生侵袭性耳念珠菌感染[7]。章某既往有2型糖尿病病史多年,长期滞留ICU,住院期间神志昏迷,气管切开状态,长期保留胃管、导尿管等导管,基础免疫功能低下,以上均为侵袭性耳念珠菌感染的高危因素。Biswal等[8]研究表明,耳念珠菌可以在人体胃肠道内长期定植,但尚未有足够的研究证明其是否可以通过肠黏膜入血,以及其入血后导致的病理变化。研究[9]显示,小鼠感染耳念珠菌14 d后,仍可从其粪便、血液和肝肾组织中分离出耳念珠菌,提示经胃肠道感染的耳念珠菌在机体免疫抑制情况下,可能会突破肠道屏障入血引起菌血症,并能随血流播散到其他组织。章某在发病前期有腹胀、肠鸣音减弱等胃肠道症状,胸腹部CT提示肠腔胀气,余无特殊,予以禁食、胃肠减压、灌肠、静脉营养等对症治疗,但效果欠佳,后期腹胀、肠鸣音减弱等临床症状未见明显改善。故综合考虑认为,发生耳念珠菌败血症的主要原因为患者前期发生胃肠道感染,后因其基础免疫力低下,耳念珠菌突破肠道屏障入血所致可能性较大。对首次检出耳念珠菌前一周内转出的3例患者进行主动筛查,均未检出耳念珠菌,结合环境筛查结果(6株耳念珠菌中的3株在章某床单元中,明显多于病区内其他患者),且章某易感因素多于其他患者,因此考虑章某为此次传播的感染源可能性较大,可能是该患者胃肠道污染物污染周围环境所致。
生物膜的形成是耳念珠菌产生较强耐药性的关键因素,耳念珠菌有686种生物膜相关蛋白(核糖体蛋白、转运蛋白、几种酶和转录因子),表达了更强的形成生物膜的能力[10]。最近一项研究[11]表明,由于耳念珠菌具有丰富的甘露聚糖多糖,生物膜隔离了近70%的三唑抗真菌药物。据美国CDC报道,约90%的耳念珠菌分离株对氟康唑耐药,30%的分离株对两性霉素B耐药,5%的分离株对棘白菌素耐药。Adams等研究[12]显示,在耳念珠菌败血症中,30天病死率为39%(12/31),90天病死率高达58%(18/31)。因本院尚未开展真菌的药敏检测,故针对章某的病情,选用卡伯芬净联合伏立康唑抗感染治疗,但效果欠佳,后期多次复查血培养均可检出耳念珠菌,在确诊16 d后,因抢救无效死亡。由此可见,即使采取重拳抗感染治疗方案,耳念珠菌败血症的治疗效果仍可能难以达到预期。
耳念珠菌可以通过接触受污染的表面和从受感染或定植的患者身上脱落的污染物传播。其可能在接触后的几天到几周内定植宿主,并在定植后的几天到几个月内发生侵入性感染[13]。耳念珠菌多定植于皮肤,尤其是腋窝和腹股沟,在模拟腋窝皮肤出汗的环境中繁殖最好[14-15],与本组筛查结果基本一致。本研究5次筛查,患者体表共检出13株耳念珠菌,仅3株发现于鼻腔,其他均在腋下和腹股沟。皮肤可携带该菌,而不造成感染,但可通过脱落的皮屑而导致医院内病原体的传播与暴发,该菌可以引起暴发或较大数量患者感染[16-18]。在美国佛罗里达州的新型冠状病毒肺炎患者病房内曾发生过耳念珠菌感染暴发[19]。本研究第一次主动筛查14例患者,8例患者皮肤均检出耳念珠菌,其中7例患者均无临床正常,考虑为定植菌。经过采取积极防控措施,7例定植患者后期复查均转阴,未在病房内发生暴发流行,由此说明,目前耳念珠菌是可防可控的,即使发现医院感染,也无需恐慌。但国外研究显示,在耳念珠菌筛查阳性、后期一次或多次筛查为阴性的患者中,仍有超过50%患者在后期筛查出阳性结果[20],因此,面对耳念珠菌医院感染时,即使多次筛查均为阴性,后期仍不能放松警惕。另外,本组1例患者腹股沟发生了严重的皮肤破溃,经对症处理后,后期逐渐好转,提示在使用2%洗必泰对患者进行擦浴时,应注意避免浸泡或液体残留,要求保持干燥。
研究[8]发现,耳念珠菌可能在患者的房间内和患者房间外的走廊、椅子、床、窗台、柜台、心电图导联、血压袖带、输液泵和呼吸机中被发现。反复使用的温度计探头和脉血氧饱和度监测探头,可能成为耳念珠菌的宿主[21]。本研究主动筛查发现,在患者使用的被套、床栏、输液泵、心电监护仪、吊塔台面、地面均检出耳念珠菌。研究[22-23]显示,耳念珠菌可以在潮湿或干燥的表面存活7 d,甚至4周。经过采取综合防控措施,该院后期环境多次复筛均未检出耳念珠菌。
接触传播是耳念珠菌引起医院感染的主要原因[16],一旦发生耳念珠菌医院感染,极易在病区,甚至医院内播散。中国目前耳念珠菌感染现状可能比报道严重,尚未被报道的原因之一可能是有些医院无条件鉴定耳念珠菌[24],本院在2021年开展基质辅助激光解吸电离飞行时间质谱技术才鉴定出此株。通过此次耳念珠菌医院感染,总结以下经验:(1)加强主动筛查频率,尤其ICU内长期住院患者;(2)加强医护人员的手卫生管理;(3)温水冲浴后,再使用2%洗必泰擦洗外耳道、鼻腔、腋窝、腹股沟等部位是预防和控制医院感染极其经济、便捷的手段;(4)感染发生后,要严格限制患者转出及转入,避免感染进一步播散。耳念珠菌的防控道路任重道远,需要科室、医院及卫生主管部门共同努力,及时发现、诊断和治疗。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Satoh K, Makimura K, Hasumi Y, et al. Candida auris sp. nov., a novel ascomycetous yeast isolated from the external ear canal of an inpatient in a Japanese hospital[J]. Microbiol Immunol, 2009, 53(1): 41-44. DOI:10.1111/j.1348-0421.2008.00083.x |
| [2] |
Wang XJ, Bing J, Zheng QS, et al. The first isolate of Candida auris in China: clinical and biological aspects[J]. Emerg Microbes Infect, 2018, 7(1): 93. |
| [3] |
Eckbo EJ, Wong T, Bharat A, et al. First reported outbreak of the emerging pathogen Candida auris in Canada[J]. Am J Infect Control, 2021, 49(6): 804-807. DOI:10.1016/j.ajic.2021.01.013 |
| [4] |
高光俊, 马娟娟, 罗小明, 等. 耳念珠菌在医院感染控制中的研究进展[J]. 中国消毒学杂志, 2021, 38(2): 136-139. Gao GJ, Ma JJ, Luo XM, et al. Research progress of Candida auris in hospital infection control[J]. Chinese Journal of Disinfection, 2021, 38(2): 136-139. |
| [5] |
中华医学会检验分会临床微生物学学组. 成人耳念珠菌感染诊治防控专家共识[J]. 临床检验杂志, 2020, 38(8): 564-570. Clinical Microbiology Group, Laboratory Branch, Chinese Medical Association. Expert consensus on diagnosis, treatment, prevention and control of adult Candida auris[J]. Chinese Journal of Clinical Laboratory Science, 2020, 38(8): 564-570. DOI:10.13602/j.cnki.jcls.2020.08.02 |
| [6] |
Takahashi K, Kita E, Konishi M, et al. Translocation model of Candida albicans in DBA-2/J mice with protein calorie malnutrition mimics hematogenous candidiasis in humans[J]. Microb Pathog, 2003, 35(5): 179-187. DOI:10.1016/j.micpath.2003.06.001 |
| [7] |
Rudramurthy SM, Chakrabarti A, Paul RA, et al. Candida auris candidaemia in Indian ICUs: analysis of risk factors[J]. J Antimicrob Chemother, 2017, 72(6): 1794-1801. DOI:10.1093/jac/dkx034 |
| [8] |
Biswal M, Rudramurthy SM, Jain N, et al. Controlling a possible outbreak of Candida auris infection: lessons learnt from multiple interventions[J]. J Hosp Infect, 2017, 97(4): 363-370. DOI:10.1016/j.jhin.2017.09.009 |
| [9] |
付雷雯, 乐婷婷, 王玲, 等. 耳念珠菌不同条件下生长特性及体内毒性[J]. 南方医科大学学报, 2020, 40(7): 1049-1055. Fu LW, Yue TT, Wang L, et al. Study on growth characteri-stics of Candida auris under different conditions in vitro and its in vivo toxicity[J]. Journal of Southern Medical University, 2020, 40(7): 1049-1055. |
| [10] |
Ciurea CN, Mare AD, Kosovski IB, et al. Candida auris and other phylogenetically related species-a mini-review of the li-terature[J]. Germs, 2021, 11(3): 441-448. DOI:10.18683/germs.2021.1281 |
| [11] |
Dominguez EG, Zarnowski R, Choy HL, et al. Conserved role for biofilm matrix polysaccharides in Candida auris drug resistance[J]. mSphere, 2019, 4(1): e00680-18. |
| [12] |
Adams E, Quinn M, Tsay S, et al. Candida auris in healthcare facilities, New York, USA, 2013-2017[J]. Emerg Infect Dis, 2018, 24(10): 1816-1824. DOI:10.3201/eid2410.180649 |
| [13] |
Forsberg K, Woodworth K, Walters M, et al. Candida auris: the recent emergence of a multidrug-resistant fungal pathogen[J]. Med Mycol, 2019, 57(1): 1-12. DOI:10.1093/mmy/myy054 |
| [14] |
Sikora A, Hashmi MF, Zahra F. Candida auris[M]//StatPearls[Internet]. Treasure Island (FL): StatPearls Publishing, 2022.
|
| [15] |
Horton MV, Johnson CJ, Kernien JF, et al. Candida auris forms high-burden biofilms in skin niche conditions and on porcine skin[J]. mSphere, 2020, 5(1): e00910-19. |
| [16] |
Eyre DW, Sheppard AE, Madder H, et al. A Candida auris outbreak and its control in an intensive care setting[J]. N Engl J Med, 2018, 379(14): 1322-1331. DOI:10.1056/NEJMoa1714373 |
| [17] |
Rhodes J, Abdolrasouli A, Farrer RA, et al. Genomic epidemiology of the UK outbreak of the emerging human fungal pathogen Candida auris[J]. Emerg Microbes Infect, 2018, 7(1): 43. |
| [18] |
Schelenz S, Hagen F, Rhodes JL, et al. First hospital outbreak of the globally emerging Candida auris in a European hospital[J]. Antimicrob Resist Infect Control, 2016, 5: 35. DOI:10.1186/s13756-016-0132-5 |
| [19] |
Prestel C, Anderson E, Forsberg K, et al. Candida auris outbreak in a COVID -19 specialty care unit-Florida, July-August 2020[J]. MMWR Morb Mortal Wkly Rep, 2021, 70(2): 56-57. |
| [20] |
Pacilli M, Kerins JL, Clegg WJ, et al. Regional emergence of Candida auris in Chicago and lessons learned from intensive follow-up at 1 ventilator-capable skilled nursing facility[J]. Clin Infect Dis, 2020, 71(11): e718-e725. |
| [21] |
Cortegiani A, Misseri G, Giarratano A, et al. The global challenge of Candida auris in the intensive care unit[J]. Crit Care, 2019, 23(1): 150. |
| [22] |
Piedrahita CT, Cadnum JL, Jencson AL, et al. Environmental surfaces in healthcare facilities are a potential source for transmission of Candida auris and other Candida species[J]. Infect Control Hosp Epidemiol, 2017, 38(9): 1107-1109. |
| [23] |
Welsh RM, Bentz ML, Shams A, et al. Survival, persistence, and isolation of the emerging multidrug-resistant pathogenic yeast Candida auris on a plastic health care surface[J]. J Clin Microbiol, 2017, 55(10): 2996-3005. |
| [24] |
Leach L, Zhu Y, Chaturvedi S. Development and validation of a real-time PCR assay for rapid detection of Candida auris from surveillance samples[J]. J Clin Microbiol, 2018, 56(2): e01223-17. |



