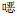 唑耐药率低于MSSA组(P < 0.01)。161株MRSA全部表达mecA基因,不表达PVL基因。SCCmec分型以SCCmec Ⅱ型(63.98%)为主,其次为SCCmec Ⅴ(16.77%)、SCCmec Ⅲ(12.42%)。结论 近年来该医院MRSA检出率虽有下降,但仍在30%左右,社区获得性感染是MRSA的重要来源。该地区儿童MRSA控制除应加强抗菌药物管理、细菌耐药监测及医院感染控制等措施外,还需加强社区管理,以降低MRSA的发生率。
唑耐药率低于MSSA组(P < 0.01)。161株MRSA全部表达mecA基因,不表达PVL基因。SCCmec分型以SCCmec Ⅱ型(63.98%)为主,其次为SCCmec Ⅴ(16.77%)、SCCmec Ⅲ(12.42%)。结论 近年来该医院MRSA检出率虽有下降,但仍在30%左右,社区获得性感染是MRSA的重要来源。该地区儿童MRSA控制除应加强抗菌药物管理、细菌耐药监测及医院感染控制等措施外,还需加强社区管理,以降低MRSA的发生率。金黄色葡萄球菌(Staphylococcus aureus,SA)表达多种毒力因子和侵袭性酶,具有较强的致病力,是一种常见的病原菌。SA可导致人类多部位感染,如菌血症,皮肤、软组织感染,心内膜炎等[1]。随着抗菌药物的广泛使用,SA对多种抗菌药物的耐药率逐年上升,特别是耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA),已成为严重公共卫生问题。PVL基因可编码导致白细胞溶解及组织坏死的膜成孔毒素,使MRSA具有高毒力[2-3]。不同地区与人群分离的SA临床特征及耐药趋势有差异,监测某地区儿童SA分离情况、耐药趋势及流行病学特征,可为临床合理使用抗菌药物及控制医院感染提供依据。
1 材料与方法 1.1 菌株来源2016—2021年苏州某儿童医院共检出SA 4 967株,随机选取其中161株MRSA进行相关基因分型及耐药基因检测。
1.2 细菌鉴定与药物敏感性试验所有临床标本分离培养均按照《全国临床检验操作规程》[3]进行,细菌鉴定使用布鲁克细菌鉴定质谱仪(MALDI Biotyper,德国布鲁克公司)。药物敏感性试验采用仪器法(VITEK 2 Compact,法国梅里埃公司)及纸片扩散法,结果以美国临床实验室标准化协会2020年标准[4]判定。纸片扩散法培养基为Mueller-Hinton(MH)琼脂平板(安图生物有限公司),质控菌株为SA ATCC 25923、ATCC 29213。
1.3 基因检测 1.3.1 DNA提取DNA提取采用生工Sangon Biotech Ezup柱式细菌基因组DNA抽提试剂盒。操作步骤严格按照试剂盒说明书进行,提取的DNA于-20℃保存。
1.3.2 基因扩增PCR引物信息见表 1。PCR反应体系:上下游引物各1 μL,10×缓冲液2 μL,模板1 μL,Taq酶0.25 μL,dNTP 2 μL,用灭菌蒸馏水补至20 μL。PCR扩增参数为:94℃预变性4 min;94℃变性30 s,55℃退火30 s,72℃延伸50 s,共35个循环,最后72℃延伸10 min。PCR产物5 μL点样于1.5%的琼脂糖凝胶中,100 V电泳45 min,通过紫外凝胶成像系统观察结果。
| 表 1 SCCmec、mecA及PVL基因PCR扩增引物及产物大小 Table 1 PCR amplification primers and the product size of SCCmec, mecA and PVL genes |

|
数据统计应用SPSS 16.0软件,两组间比较采用χ2检验。检出水准α=0.05。
2 结果 2.1 不同年份及季节SA及MRSA检出情况2016—2021年,该院共检出SA 4 967株,其中,MRSA检出1 730株(34.83%)。2019年检出MRSA最多(443株),2018年MRSA检出率(39.25%)最高。2016—2021年MRSA检出率依次为28.27%(203/718)、32.28%(255/790)、39.25%(400/1 019)、38.79%(443/1 142)、30.92%(222/718)和35.69%(207/580)。从季节分布来看,SA全年均可检出,不同季节MRSA检出率比较,差异无统计学意义(χ2=0.992,P=0.803),见表 2。
| 表 2 不同季节SA及MRSA的检出情况 Table 2 Detection of SA and MRSA in different seasons |
|
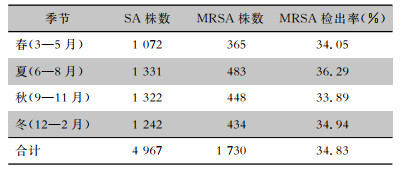
2016—2021年,SA及MRSA检出株数最多的标本均为痰,不同标本中MRSA检出率比较,差异无统计学意义(χ2=16.800,P=0.603)。见表 3。
| 表 3 不同标本中SA及MRSA的检出情况 Table 3 Detection of SA and MRAS in different specimens |
|
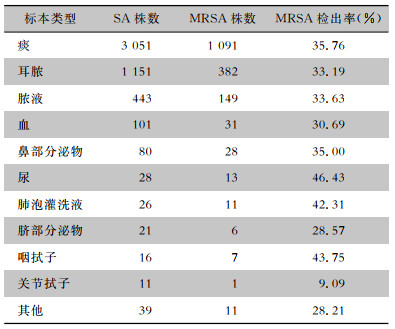
2016—2021年,该院住院患儿共检出SA 3 796株(76.42%),其中MRSA 1 346株,检出率35.46%,不同年份住院患儿MRSA检出率比较,差异有统计学意义(χ2=23.770,P=0.001)。门诊患儿共检出SA 1 171株(23.58%),其中MRSA 384株,检出率32.79%,不同年份门诊患儿MRSA检出率比较,差异无统计学意义(χ2=1.731,P=0.885)。见表 4。SA感染患儿的男女比例为1.42 ∶1,MRSA感染患儿男女比例为1.44 ∶1。
| 表 4 不同年份门诊和住院患儿SA及MRSA检出情况 Table 4 Detection of SA and MRSA in outpatient and hospitalized children in different years |
|
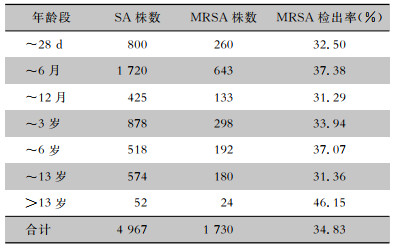
该院SA及MRSA检出最多的科室为呼吸科,MRSA检出率从高到低依次为神经内科(66.67%,4/6)、神经外科(59.09%,13/22)、耳鼻喉科(54.05%,20/37)、其他内科(45.00%,72/160)、急诊病区(43.68%,38/87)、心内科(42.86%,42/98)、消化内科(41.18%,21/51)、呼吸内科(36.37%,447/1 229)、感染疾病科(35.90%,56/ 156)、肾脏内科(33.94%,37/109)、血液科(33.59%,44/131)、耳鼻喉门诊(33.51%,376/1 122)、ICU(32.87%,143/435)、新生儿科(32.54%,288/885)、外科(31.56%,89/282)、泌尿外科(30.77%,4/13)、骨科(29.47%,28/95)、门诊外科(26.67%,4/15)和门诊内科(15.38%,4/26)。皮肤科检出SA 7株,烧伤整形科检出SA 1株,两科室均无MRSA检出。不同年龄段患儿MRSA检出率比较,差异无统计学意义(χ2=7.960,P=0.241)。见表 5。
| 表 5 不同年龄段患儿SA及MRSA的检出情况 Table 5 Detection of SA and MRSA in children of different age groups |
|
检出的SA对青霉素耐药率较高。MRSA对红霉素、四环素的耐药率高于甲氧西林敏感的金黄色葡萄球菌(MSSA),但对复方磺胺甲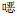
| 表 6 MRSA和MSSA对抗菌药物的药敏结果 Table 6 Antimicrobial susceptibility test of MRSA and MSSA |
|
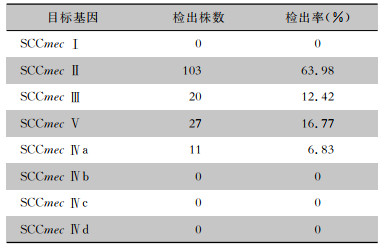
161株MRSA全部表达mecA基因,未检出PVL基因。SCCmec基因分型显示以Ⅱ型为主(63.98%),其次是Ⅴ、Ⅲ型。见表 7。
| 表 7 SCCmec在MRSA中的检出情况(n=161) Table 7 Detection of SCCmec in MRSA(n=161) |
|
SA是临床检出数量最多的革兰阳性菌。由于抗菌药物的广泛使用,MRSA的检出率居高不下。2016—2021年,该儿童医院共检出SA 4 967株,MRSA平均检出率为34.83%,低于成人医院检出率[4],提示即使同一地区,不同医院间成人和儿童MRSA的检出率也存在差异, 可能与用药习惯、标本来源等有关。2016—2018年,MRSA检出率呈上升趋势,2019年出现下降。所以,及时监测该院儿童MRSA的检出与分布情况有利于临床治疗与防控。
SA广泛分布于人体皮肤及鼻咽部。本研究显示,检出SA及MRSA最多的标本是痰,其次是耳脓、脓液,与其他地区研究[5]认为呼吸道标本是SA主要来源的结果一致,但MRSA在各类标本中的检出率差异无统计学意义。检出SA及MRSA最多的科室是呼吸科,其次是耳鼻喉门诊及新生儿科。呼吸科送检的痰等标本数量较多,所以SA及MRSA检出数量也较多。本研究中,耳脓标本检出数量也较多,可能儿童易发生上呼吸道感染并发中耳炎感染,而SA是儿童中耳炎的主要致病菌[6-7]。因此,预防和控制SA感染需要加强儿童呼吸道及相关易感部位的感染控制。此外,不同季节、不同年龄段患儿、门诊患儿不同年份的MRSA检出率差异无统计学意义;住院患儿可能由于病情严重接受抗菌药物治疗而降低检出率,或因有创检查导致检出率增加,其不同年份间MRSA检出率比较,差异有统计学意义,提示MRSA的防控无季节、年龄偏向性,社区防控与医院防控同样重要。
本研究显示,SA对青霉素及红霉素的耐药率较高,未检出万古霉素、替考拉宁及利奈唑胺的耐药菌株。MRSA对大环内酯类、四环素类的耐药率高于MSSA(P < 0.01),但对喹诺酮类、氨基糖苷类、复方磺胺甲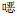
MRSA耐药是由于SA携带mecA、mecB、mecC、mecD等基因,编码了对β-内酰胺类抗生素亲和力较低的青霉素结合蛋白[8]。本研究随机选取的161株MRSA全部表达mecA基因,提示该院MRSA主要携带mecA基因。mecA基因位于可移动元件SCCmec上,而SCCmec元件在菌株间进行水平转移是导致SA耐药性增加的原因之一[9]。不同地区MRSA流行的SCCmec基因型存在差异,如徐州地区以SCCmec Ⅱ为主,其次为SCCmec Ⅲ及SCCmec Ⅳ[10],而本研究显示,苏州地区儿童检出的MRSA以SCCmec Ⅱ(63.98%)为主,其次为SCCmec Ⅴ(16.77%)、SCCmec Ⅲ(12.42%)。研究[11]认为SCCmec Ⅰ、SCCmec Ⅱ、SCCmec Ⅲ主要为医院获得性MRSA,而SCCmec Ⅳ及SCCmec Ⅴ主要为社区获得性MRSA。夏雯等[12]发现某院ICU检出的MRSA中,毒力基因PVL检出率达65.22%,而罗伯特·科赫研究所的国家葡萄球菌和肠球菌参考中心(Wernigerode部分)2005—2006年间检出的4 815株MRSA中,PVL阳性菌株比例较低,仅117株(2.4%)[13],与本研究结果(0/161)类似。因此,推断本地区儿童感染的MRSA毒力较成人检出株弱,但或与本研究入选的菌株数量有限有关。SCCmec分型结果提示,阻止MRSA在儿童之间传播,除了加强医院内感染控制,还应加强社区卫生健康教育,减少社区获得性MRSA的播散。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Pandit BR, Vyas A. Clinical symptoms, pathogen spectrum, risk factors and antibiogram of suspected neonatal sepsis cases in tertiary care hospital of southern part of Nepal: a descriptive cross-sectional study[J]. JNMA J Nepal Med Assoc, 2020, 58(232): 976-982. |
| [2] |
Pimentel de Araujo F, Monaco M, Del Grosso M, et al. Staphylococcus aureus clones causing osteomyelitis: a literature review (2000-2020)[J]. J Glob Antimicrob Resist, 2021, 26: 29-36. DOI:10.1016/j.jgar.2021.03.030 |
| [3] |
Zhu YL, Tang Z, Huo SH, et al. Regulatory relationship between macrophage autophagy and PVL-positive methicillin-resistant Staphylococcus aureus[J]. Immunobiology, 2022, 227(3): 152223. DOI:10.1016/j.imbio.2022.152223 |
| [4] |
吴湜, 胡付品, 蒋晓飞, 等. 2019年上海市三级医院细菌耐药监测[J]. 中国感染与化疗杂志, 2021, 21(1): 1-10. Wu S, Hu FP, Jiang XF, et al. Surveillance of bacterial resistance in tertiary hospitals across Shanghai in 2019[J]. Chinese Journal of Infection and Chemotherapy, 2021, 21(1): 1-10. |
| [5] |
田英杰, 于慧, 王占黎. 金黄色葡萄球菌耐药性及相关耐药基因分析[J]. 中国中西医结合急救杂志, 2019(2): 197-200. Tian YJ, Yu H, Wang ZL. Analysis of drug resistance and related drug resistance genes of Staphylococcus aureus[J]. Chinese Journal of Integrated Traditional and Western Medicine in Intensive and Critical Care, 2019(2): 197-200. DOI:10.3969/j.issn.1008-9691.2019.02.015 |
| [6] |
方盼盼, 王颍源, 杨俊文, 等. 儿童慢性化脓性中耳炎病原菌分布及耐药性分析[J]. 听力学及言语疾病杂志, 2021, 29(1): 5-9. Fang PP, Wang YY, Yang JW, et al. Distribution and drug resistance of pathogenic bacteria in children with chronic suppurative otitis media[J]. Journal of Audiology and Speech Pathology, 2021, 29(1): 5-9. DOI:10.3969/j.issn.1006-7299.2021.01.002 |
| [7] |
高晓宇, 徐淑芳, 俞娟, 等. 330例儿童急性化脓性中耳炎分泌物病原菌分布和耐药性分析[J]. 宁夏医科大学学报, 2021, 43(7): 711-714. Gao XY, Xu SF, Yu J, et al. Analysis of the distribution and drug resistance of pathogenic bacteria in the secretions of 330 children with acute suppurative otitis media[J]. Journal of Ningxia Medical University, 2021, 43(7): 711-714. |
| [8] |
武杰, 赵建平. MRSA的检测、耐药、流行及抗菌药物选择的研究进展[J]. 中国抗生素杂志, 2021, 46(9): 837-844. Wu J, Zhao JP. Advances in detection, drug resistance, preva-lence, and antimicrobial agent selection of MRSA[J]. Chinese Journal of Antibiotics, 2021, 46(9): 837-844. DOI:10.3969/j.issn.1001-8689.2021.09.004 |
| [9] |
Maree M, Thi Nguyen LT, Ohniwa RL, et al. Natural transformation allows transfer of SCCmec-mediated methicillin resistance in Staphylococcus aureus biofilms[J]. Nat Commun, 2022, 13(1): 2477. DOI:10.1038/s41467-022-29877-2 |
| [10] |
纵帅, 徐萍萍, 顾兵, 等. 徐州地区116株MRSA耐药性分析与分子流行病学调查[J]. 中国感染控制杂志, 2017, 16(2): 104-108. Zong S, Xu PP, Gu B, et al. Antimicrobial resistance and molecular epidemiology of 116 strains of methicillin-resistant Staphylococcus aureu in Xuzhou area[J]. Chinese Journal of Infection Control, 2017, 16(2): 104-108. |
| [11] |
Lakhundi S, Zhang KY. Methicillin-resistant Staphylococcus aureus: molecular characterization, evolution, and epidemiology[J]. Clin Microbiol Rev, 2018, 31(4): e00020-18. |
| [12] |
夏雯, 吴亮, 阴晴, 等. 某院ICU医院获得性肺炎患者痰分离MRSA耐药基因和pvl基因携带情况[J]. 中国感染控制杂志, 2019, 18(6): 525-530. Xia W, Wu L, Yin Q, et al. Carrying status of resistances genes and pvl gene in MRSA isolated from sputum of patients with healthcare-associated pneumonia in ICU of a hospital[J]. Chinese Journal of Infection Control, 2019, 18(6): 525-530. |
| [13] |
Balakirski G, Hischebeth G, Altengarten J, et al. Recurrent mucocutaneous infections caused by PVL-positive Staphylococcus aureus strains: a challenge in clinical practice[J]. J Dtsch Dermatol Ges, 2020, 18(4): 315-322. |



