2. 兰州大学第一临床医学院, 甘肃 兰州 730000;
3. 兰州市肺科医院二病区, 甘肃 兰州 730000;
4. 兰州大学第一医院传染科, 甘肃 兰州 730000
2. The First School of Clinical Medicine, Lanzhou University, Lanzhou 730000, China;
3. The Second Ward of Lanzhou Pulmonary Hospital, Lanzhou 730000, China;
4. Department of Infectious Diseases, the First Hospital of Lanzhou University, Lanzhou 730000, China
近年来,随着广谱抗菌药物广泛使用,临床实验室耐药菌分离率逐年上升,尤其耐碳青霉烯类肠杆菌目细菌(carbapenem-resistant Enterobacterales, CRE)检出率和耐药率不断上升,给临床抗感染治疗带来新的挑战, 引起了医学界的高度关注[1]。消毒和灭菌是阻止耐药菌传播,减少医院感染最好的办法,重视消毒灭菌管理是控制医院感染发生的重要环节。随着耐消毒剂菌株分离率不断上升,消毒频率和剂量使用逐渐加大,尤其消毒剂不规范使用,使病原菌长时间暴露在消毒剂环境中,逐渐形成质粒或者染色体变异。文献[2]报道,获得遗传物质编码的耐药性可稳定遗传,从而引发医院感染及严重的耐药问题。本研究收集某院临床标本分离的CRE,分析菌株耐药性及临床特征,检测耐消毒剂基因和四种消毒剂最低抑菌浓度(minimum inhibitory concentration, MIC)值,为防止医院感染,选择科学有效的消毒方式提供依据。
1 资料与方法 1.1 菌株来源选取兰州大学第一医院2021年10月—2022年3月住院患者临床送检各类标本(血、痰、尿、胸腔积液、腹腔积液、分泌物、胆汁等)分离的CRE菌株,选择首次送检标本中分离菌株, 剔除同一患者多次送检相同标本中重复菌株。
1.2 仪器和试剂VITEK MS时间飞行质谱检测系统、VITEK 2 Compact细菌鉴定药敏分析系统(法国生物梅里埃公司)及配套GN334药敏卡、MH平板、哥伦比亚血平板和麦康凯平板(郑州安图公司)、K-B法药敏纸片(英国OXOID公司)、TaqDNA预混酶(TaKaRa公司)、DNA Marker DL1000(TaKaRa公司)、琼脂糖(北京智杰方远科技有限公司)、乙醇、碘伏、戊二醛、84消毒剂、ALPEP凝胶成像仪(美国通用电气)、PCR扩增仪(杭州博日科技有限公司)、电泳仪(北京市六一仪器厂)。引物由宝生物工程(大连)有限公司合成。
1.3 菌株鉴定和药敏试验严格按照第4版《全国临床检验操作规程》标准执行病原菌鉴定和药敏试验[3]。采用MALDI-TOF-MS质谱鉴定系统与VITEK 2 Compact细菌鉴定药敏分析系统对菌株进行鉴定和药敏试验,部分药敏试验选用K-B法,药敏结果根据美国临床实验室标准化协会(CLSI)M100-S31进行判断,质控菌株采用大肠埃希菌ATCC 25922和ATCC 8099(温州市康泰生物科技有限公司)。
1.4 耐消毒剂基因检测根据文献[4-5]设计合成耐消毒剂基因qacE、qacE△1、qacE△1-SUL1 3对引物序列,见表 1。采用煮沸法提取DNA模板。PCR扩增体系总体积为25 μL,Taq DNA Mix酶12.5 μL,DNA模板2 μL,上下游引物各1 μL,无菌纯水补足至25 μL。扩增检测靶基因, 扩增产物用1.5%琼脂糖凝胶电泳成像观察结果, 试验过程设阴性、阳性对照, 对阳性扩增产物进行测序确认,测序使用标准双脱氧链终止法流程,测序结果利用美国国家生物技术中心的基本局部匹配查询工具进行比对、确认、分型。
| 表 1 耐消毒剂基因PCR引物序列及产物大小 Table 1 PCR primer sequences and product size for disinfectant-resistant genes |
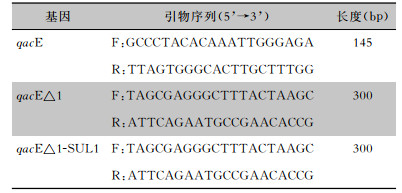
|
将戊二醛、碘伏、84消毒剂和乙醇分别倍比稀释为6个不同浓度。戊二醛浓度分别为2 000、1 000、500、250、125、62.5 mg/L, 碘伏浓度为5 000、2 500、1 250、625、312.5、156.25 mg/L, 84消毒剂(有效氯浓度)为1 000、500、250、125、62.5、31.25 mg/L,乙醇浓度为75%、37.5%、18.75%、9.37%、4.68%、2.34%。将不同浓度的消毒剂加入到经高压灭菌的MH琼脂中混匀,待凝固后备用(培养皿内含2 mL消毒剂+18 mL MH琼脂)。取血平板上少量新鲜试验菌株, 置无菌试管内壁研磨至充分混匀,比浊仪调试0.5麦氏单位浊度,高压灭菌去离子水1 ∶10倍稀释,最后将稀释后菌悬液滴种至含有不同浓度消毒剂的MH平板,将平板置于35~37℃普通培养箱18~24 h,观察记录试验结果。抑制待测菌生长的浓度为其该消毒剂的MIC值,所有试验重复3次。标准菌株大肠埃希菌ATCC 8099测试MIC值方法同上。
1.6 统计学分析应用WHONET 5.6软件和SPSS 21.0软件进行处理和分析, 计数资料采用例数和百分率表示。
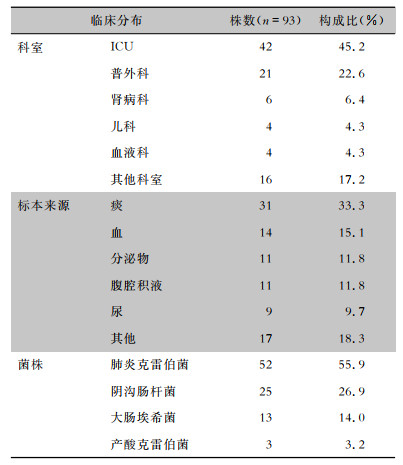
2 结果 2.1 临床资料93株临床分离非重复CRE菌株,包括肺炎克雷伯菌52株,阴沟肠杆菌25株,大肠埃希菌13株和产酸克雷伯菌3株。标本来源主要为痰(31株)、血(14株)、分泌物(11株),科室分布主要为重症监护病房(ICU, 42株)和普外科(21株)。见表 2。
| 表 2 93株CRE菌株临床分布情况 Table 2 Clinical distribution of 93 CRE strains |
|
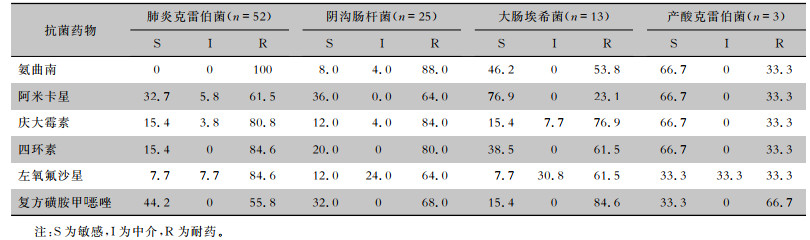
93株CRE菌株对亚胺培南、美罗培南、厄他培南、头孢他啶、头孢哌酮/舒巴坦、氨苄西林、氨苄西林/舒巴坦、哌拉西林/他唑巴坦、阿莫西林/克拉维酸、头孢唑林、头孢呋辛、头孢曲松、头孢吡肟、头孢西丁14种药物耐药率均为100%。52株肺炎克雷伯菌对复方磺胺甲
| 表 3 93株CRE菌株药敏试验结果 Table 3 Antimicrobial susceptibility test of 93 CRE strains |
|
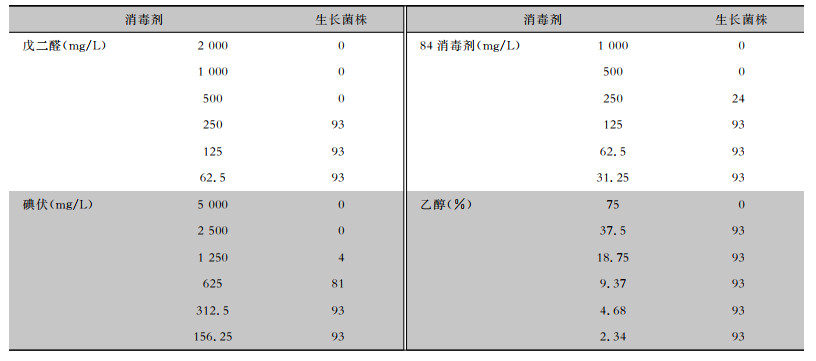
戊二醛、乙醇对93株CRE的MIC值分别为500 mg/L、75%。碘伏对CRE的MIC值为625~2 500 mg/L,其中12株的MIC值为625 mg/L,77株的MIC值1 250 mg/L,4株的MIC值为2 500 mg/L;84消毒剂(有效氯浓度)对CRE的MIC值为250~500 mg/L,其中69株的MIC值为250 mg/L,24株的MIC值为500 mg/L,见表 4。戊二醛、碘伏、84消毒剂(有效氯浓度)和乙醇对标准菌株大肠埃希菌ATCC 8099的MIC值分别为500 mg/L、1 250 mg/L、250 mg/L和75%。
| 表 4 四种消毒剂对93株CRE的MIC值分布情况 Table 4 MICs of four disinfectants to 93 CRE strains |
|
93株CRE菌株,86株(92.5%)携带本研究关注的耐消毒剂基因,部分菌株PCR结果琼脂糖凝胶电泳图见图 1~3。经测序确认, 67株菌携带qacE基因(肺炎克雷伯菌37株,阴沟肠杆菌20株,大肠埃希菌8株及产酸克雷伯2株),76株菌携带qacE△1基因(肺炎克雷伯菌43株,阴沟肠杆菌21株,大肠埃希菌10株及产酸克雷伯2株),83株菌携带qacE△1-SUL1基因(肺炎克雷伯菌46株,阴沟肠杆菌23株,大肠埃希菌12株及产酸克雷伯菌2株)。
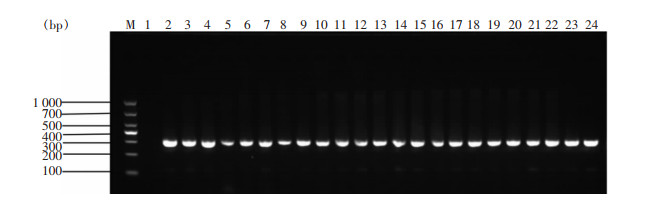 |
| 注:泳道M为DNA Marker,泳道1为阴性对照,泳道2为阳性对照,泳道3~24为PCR扩增阳性标本。 图 1 部分CRE菌株qacE△1-SUL1基因PCR产物电泳图 Figure 1 Electrophoresis map of PCR products of qacE△1-SUL1 gene from partial CRE strains |
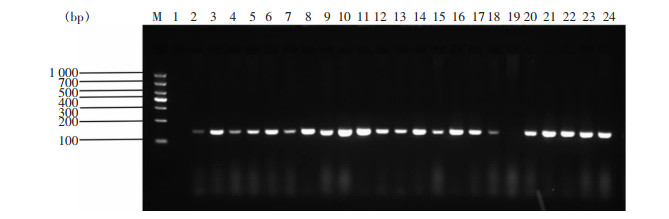 |
| 注:泳道M为DNA Marker,泳道1为阴性对照,泳道2~18、20~24为PCR扩增阳性标本,泳道19为PCR扩增阴性标本。 图 2 部分CRE菌株qacE基因PCR产物电泳图 Figure 2 Electrophoresis map of PCR products of qacE gene from partial CRE strains |
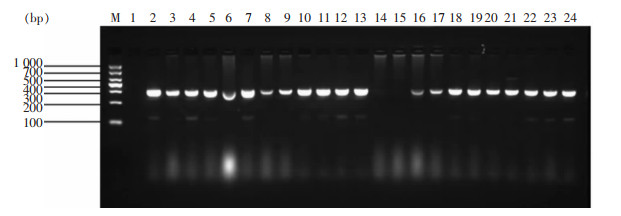 |
| 注:泳道M为DNA Marker,泳道1为阴性对照,泳道2~13、16~24为PCR扩增阳性标本,泳道14、15为PCR扩增阴性标本。 图 3 部分CRE菌株qacE△1基因PCR产物电泳图 Figure 3 Electrophoresis map of PCR products of qacE△1 gene from partial CRE strains |
肠杆菌目细菌耐药问题已成为抗感染领域研究热点,尤其CRE的出现,给临床治疗提出了新的挑战。近年来,临床微生物实验室CRE分离率呈逐渐上升趋势。碳青霉烯类抗菌药物具有毒性小、活性强、稳定性高和抗菌谱广等优点,被认为是临床抗感染治疗的最后一道防线[6],该类抗菌药物大量使用可能是导致CRE检出率逐年增高的原因[7]。世界卫生组织(WHO)将CRE列为对人类健康具有最大威胁的细菌之一[8]。耐药菌株CRE引起医院感染, 对医院感染防控,临床抗感染治疗,以及降低CRE感染患者的死亡风险有重大意义。
93株CRE临床资料显示,标本来源主要为呼吸道标本痰(31株,33.33%),其次为血(14株,15.1%);科室分布主要为ICU(42株,45.2%),其次为普外科(21株,22.6%)。呼吸道标本CRE分离率高的原因一方面是医院痰标本送检量大,另一方面是许多重症患者通常使用呼吸机,气管切开、插管、机械通气等因素均是引起肺部感染的危险因素。其次CRE在血标本中分离率较高,可能与该院重症患者较多,或治疗过程中侵入性操作多有关,应该引起临床医院感染的足够重视。ICU(包括儿科、门急诊、心内科等ICU)和普外科是该院优势学科,以上科室病床多、病源量大、收治病种复杂,患者住院周期长,尤其碳青霉烯类抗生素使用,治疗性的侵入操作多等因素可能是CRE分离率高的原因。
本研究分离居前3位的CRE病原菌分别是肺炎克雷伯菌(52株,55.9%)、阴沟肠杆菌(25株,26.9%) 和大肠埃希菌(13株,14.1%),与相关文献[9]报道的结果相近。药敏试验结果显示,菌株耐药率较高,对青霉素类、头孢菌素类以及酶抑制剂临床常用抗菌药物的耐药率达100%,尤其对被称为革兰阴性菌治疗最后一道防线的碳青霉烯类抗生素耐药率均高达100%。52株肺炎克雷伯菌对复方磺胺甲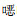
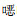
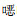
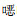
细菌耐药问题已不仅局限抗菌药物使用,耐消毒剂细菌的出现将对医院消毒和感染防控产生重大影响。文献[12]报道,在亚致死剂量消毒剂或消毒剂作用时间不当的情况下,有些细菌出现对消毒剂的抗性。尤其近三年新型冠状病毒肺炎(COVID -19)全球大流行,消毒剂使用问题尤为突出,细菌长时间暴露于消毒剂环境中,逐渐出现质粒或染色体变异,最终获得遗传物质编码的耐药性并稳定遗传,表现出对消毒剂的抗性[13-14]。因此检测耐消毒剂基因,科学选择消毒剂,指导临床合理用药及控制耐药基因传播具有重大意义[14]。
目前研究较多的是由质粒介导的qac基因家族,包括qacA、qacB、qacC、qacD、qacE、qacE△1、qacE△1-SUL1、qacF、qacG、qacH、qacJ,其中qacE△1是qacE基因的突变缺失型[2], 基因qacEΔ1编码胍类、季铵盐类等消毒剂的外排蛋白,与基因qacE△1-SUL1叠加,引起磺胺类抗菌药物耐药,可被革兰阴性菌广泛获取[15]。本研究试验结果显示,93株CRE中86株(92.5%)携带研究关注的耐消毒剂基因。经测序确认, 67株菌携带qacE基因,76株菌携带qacE△1基因,83株菌携带qacE△1-SUL1基因,总体耐消毒剂基因携带率较高。一方面可能是医院消毒剂使用方法和浓度的不合理选择,长期的选择性压力导致严重的消毒剂耐药现象;另一方面也不排除耐药基因在菌株之间水平传播的可能。
消毒剂是在医疗机构中使用范围广、用量大和频率高的物质,容易引起病原体产生消毒剂抗性。消毒剂抗性是一个相对概念,至今国内外暂未见关于检测和判断消毒剂抗性的标准,任何试验方法都有局限性,目前主要采用测定消毒剂MIC值评估某种消毒剂的敏感性变化及趋势,将测定结果与标准菌株比较,高于标准菌株MIC值判定为抗性[16]。本组研究选用琼脂稀释法检测四种消毒剂对CRE的MIC值,其中戊二醛为500 mg/L,碘伏为625~2 500 mg/L,84消毒剂(有效氯浓度)为250~500 mg/L,乙醇为75%;戊二醛、碘伏、84消毒剂(有效氯浓度)和乙醇对大肠埃希菌ATCC 8099标准菌株的MIC值分别为500 mg/L、1 250 mg/L、250 mg/L和75%。结果显示,受试四种消毒剂中,戊二醛、乙醇对本组CRE的MIC值与标准菌株相同, 碘伏MIC值中有4株(2 500 mg/L)高于标准菌株, 84消毒剂(有效氯浓度)MIC值中有24株(500 mg/L)高于标准菌株。84消毒剂和碘伏属于医院消毒最常用的消毒剂,具有强大的杀菌效果,医疗活动中长期大量使用,部分CRE菌株对84消毒剂和碘伏已出现抗性。CRE菌株出现消毒剂抗性, 可能与携带消毒剂耐药基因相关,具体机制还需进一步研究证实。对于产生抗性的细菌,可以使用该消毒剂,但需要延长消毒时间或加大剂量,可达到消毒效果[17]。
目前,文献报道的抗菌药物耐药和消毒剂耐药之间关系不全一致,但有研究证实细菌对消毒剂敏感性降低甚至耐药会影响抗菌药物敏感性[18],抗菌药物与消毒剂耐药机制是否相关值得进一步探讨。本研究由于收集试验菌株有限,只关注了3种耐消毒剂基因,大部分标本来自ICU,可能存在一定的偏倚。对消毒剂耐受菌株,究竟需要延迟多长时间或者加大到多少浓度还没有确切的数据,还需进一步研究。
综上所述,医疗机构应该严格按照消毒标准,正确、合理、规范选择消毒剂、稀释浓度和作用时间,防止抗菌药物和消毒剂双重耐药菌产生和传播,倡导医院感染管理机构建立耐消毒剂检测机制,指导临床合理使用消毒剂。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Saeed NK, Alkhawaja S, Azam NFAEM, et al. Epidemiology of carbapenem-resistant Enterobacteriaceae in a tertiary care center in the Kingdom of Bahrain[J]. J Lab Physicians, 2019, 11(2): 111-117. DOI:10.4103/JLP.JLP_101_18 |
| [2] |
张亚萍, 陈勇, 王文英, 等. 临床分离大肠埃希菌耐消毒剂基因携带情况及5种消毒剂最低抑菌浓度[J]. 中国感染控制杂志, 2016, 15(5): 289-293. Zhang YP, Chen Y, Wang WY, et al. Carriage of disinfectant resistance genes in clinically isolated Escherichia coli and minimal inhibitory concentration of five disinfectants[J]. Chinese Journal of Infection Control, 2016, 15(5): 289-293. |
| [3] |
尚红, 王毓三, 申子瑜. 全国临床检验操作规程[M]. 4版. 北京: 人民卫生出版社, 2015: 574-625. Shang H, Wang YS, Shen ZY. National guide to clinical laboratory procedures[M]. 4th ed. Beijing: People's Medical Publishing House, 2015: 574-625. |
| [4] |
Zou LK, Meng JH, McDermott PF, et al. Presence of disinfectant resistance genes in Escherichia coli isolated from retail meats in the USA[J]. J Antimicrob Chemother, 2014, 69(10): 2644-2649. DOI:10.1093/jac/dku197 |
| [5] |
王慧敏, 金慧, 孔庆鑫, 等. 某传染病医院医疗污水中耐药及耐消毒剂基因检测[J]. 中国消毒学杂志, 2022, 39(10): 727-729, 732. Wang HM, Jin H, Kong QX, et al. Detection and analysis on drug and disinfectant resistance gene in sewage of a hospital for infection disease in Hangzhou[J]. Chinese Journal of Disinfection, 2022, 39(10): 727-729, 732. |
| [6] |
孙红娟, 吕庆排, 黄敏, 等. 某院2010—2019年常见肠杆菌目细菌临床分布及耐药性变迁[J]. 中国感染控制杂志, 2021, 20(6): 524-531. Sun HJ, Lv QP, Huang M, et al. Clinical distribution and antimicrobial resistance of common Enterobacterales in a hospital in 2010-2019[J]. Chinese Journal of Infection Control, 2021, 20(6): 524-531. |
| [7] |
Torres-Gonzalez P, Cervera-Hernandez ME, Niembro-Ortega MD, et al. Factors associated to prevalence and incidence of carbapenem-resistant Enterobacteriaceae fecal carriage: a cohort study in a Mexican tertiary care hospital[J]. PLoS One, 2015, 10(10): e0139883. DOI:10.1371/journal.pone.0139883 |
| [8] |
World Health Organization. WHO publishes list of bacteria for which new antibiotics are urgently needed[EB/OL]. (2017-02-27)[2022-04-27]. https://www.who.int/news/item/27-02-2017-who-publishes-list-of-bacteria-for-which-new-antibiotics-are-urgently-needed.
|
| [9] |
胡付品, 郭燕, 朱德妹, 等. 2020年CHINET中国细菌耐药监测[J]. 中国感染与化疗杂志, 2021, 21(4): 377-387. Hu FP, Guo Y, Zhu DM, et al. CHINET surveillance of bacterial resistance: results of 2020[J]. Chinese Journal of Infection and Chemotherapy, 2021, 21(4): 377-387. |
| [10] |
时芳芳, 李轶, 韦慧玲, 等. 某医院临床分离耐碳青霉烯类肠杆菌科细菌耐药特点及耐药基因分析[J]. 中国消毒学杂志, 2021, 38(12): 896-899. Shi FF, Li Y, Wei HL, et al. Drug resistance characteristic and resistance genes of carbapenem-resistant Enterobacteriaceae isolated from a hospital[J]. Chinese Journal of Disinfection, 2021, 38(12): 896-899. DOI:10.11726/j.issn.1001-7658.2021.12.006 |
| [11] |
Trepanier P, Mallard K, Meunier D, et al. Carbapenemase-producing Enterobacteriaceae in the UK: a national study (EuSCAPE-UK) on prevalence, incidence, laboratory detection methods and infection control measures[J]. J Antimicrob Chemother, 2017, 72(2): 596-603. DOI:10.1093/jac/dkw414 |
| [12] |
Zhang AY, He XM, Meng Y, et al. Antibiotic and disinfec-tant resistance of Escherichia coli isolated from retail meats in Sichuan, China[J]. Microb Drug Resist, 2016, 22(1): 80-87. DOI:10.1089/mdr.2015.0061 |
| [13] |
Van Breda LK, Ward MP. Evidence of antimicrobial and disinfectant resistance in a remote, isolated wild pig population[J]. Prev Vet Med, 2017, 147: 209-212. |
| [14] |
王文英, 陈勇, 张亚萍, 等. 临床分离肺炎克雷伯杆菌对消毒剂耐药性观察[J]. 中国消毒学杂志, 2016, 33(7): 635-638. Wang WY, Chen Y, Zhang YP, et al. Observation on drug resistance of clinical isolated Klebsiella pneumoniae[J]. Chinese Journal of Disinfection, 2016, 33(7): 635-638. |
| [15] |
陈丹丹, 陈宏斌, 吴敏校, 等. 耐消毒剂基因qacEΔ1-sul1在CRE中的流行病学分析及其机制研究[J]. 实用中西医结合临床, 2021, 21(20): 8-10. Chen DD, Chen HB, Wu MX, et al. Epidemiology analysis of the disinfectant-resistant gene qacEΔ1-sul1 and it's mechanism research in CRE[J]. Practical Clinical Journal of Integrated Traditional Chinese and Western Medicine, 2021, 21(20): 8-10. |
| [16] |
张弟强, 张娟胜, 王国庆. 细菌对消毒剂抗性机制的研究进展[J]. 中国消毒学杂志, 2017, 34(7): 675-679. Zhang DQ, Zhang JS, Wang GQ. Research progress on the resistance mechanism of bacteria to disinfectants[J]. Chinese Journal of Disinfection, 2017, 34(7): 675-679. |
| [17] |
李祥, 鲁辛辛. 耐碳青霉烯类肺炎克雷伯菌对84消毒液抗性的试验研究[J]. 中国消毒学杂志, 2020, 37(8): 564-566. Li X, Lu XX. Experimental study on the resistance of carba-penemresistant Klebsiella pneumoniae to 84 disinfectant[J]. Chinese Journal of Disinfection, 2020, 37(8): 564-566. |
| [18] |
Meyer B, Cookson B. Does microbial resistance or adaptation to biocides create a hazard in infection prevention and control?[J]. J Hosp Infect, 2010, 76(3): 200-205. |



