2020年以来,冷链食品的进口及其运输引发了多起新型冠状病毒(简称新冠病毒)感染及传播事件,且在大流行初期肉类加工厂和渔业工人新冠病毒感染率较高[1-3]。后续研究发现,新冠病毒在低温下具有更长的存活时间,以及物传人的能力[4],提示冷链运输工程需要科学有效的消毒措施。由于低温凝固导致大部分消毒剂的消毒效果明显减弱[5],常用化学消毒剂在低于0℃的环境下会冻结无法发挥消毒作用。因此,降低化学消毒剂的冰点,提高低温消毒效果是冷链消毒亟待解决的问题。
《冷链食品生产经营过程新冠病毒防控消毒技术指南》[6]提出,冷冻物体表面消毒需添加防冻剂,确保消毒剂不凝固并进行消毒效果评估。通过科学配比和组合,复方过氧化物消毒剂可以提高杀菌效果,减少消毒剂的副作用[7],可满足多种场景的消毒要求。然而,复方过氧化物消毒在低温下的消毒效果并未阐明,本研究采用复方过氧化物消毒剂,按照2002年版《消毒技术规范》[8]及《低温消毒剂卫生安全评价技术要求》(国卫办监督函[2020]1062号)[9]的要求,以甘油、丙醇作为防冻剂进行配制,观察其在低温条件下实验室杀灭细菌、病毒,以及现场消毒效果,并评价其安全性。
1 材料与方法 1.1 试验材料 1.1.1 复方过氧化物消毒剂中国本土企业生产,为一元包装消毒剂,有效期12个月。其中组分过氧乙酸含量为57.5 g/L,过氧化氢含量为245 g/L,原液的pH值为0.52。
1.1.2 中和剂由50 g/L的硫代硫酸钠(Na2S2O3)、30 g/L的吐温-80、3 g/L的卵磷脂、10 g/L组氨酸的胰蛋白胨生理盐水溶液(tryptone physiology solution, TPS)及10 g/L Na2S2O3的最低必需培养基(minimum essential medium, MEM)组成,按要求鉴定合格,分别适用于杀菌及病毒灭活试验。
1.1.3 受试微生物金黄色葡萄球菌ATCC 6538与大肠埃希菌8099,均购自中国普通微生物菌种保藏管理中心;脊髓灰质炎病毒1型菌株购自国家脊灰实验室。
1.1.4 载体以规格为1.0 cm×1.0 cm的脱脂平纹白棉布和规格为5.0 cm×5.0 cm的牛皮纸为载体,灭菌后备用。
1.2 试验方法 1.2.1 菌悬液及染菌载体制备按《消毒技术规范》要求,将各个试验菌株分离培养,以单一典型菌落接种营养琼脂培养基斜面,然后用胰蛋白胨大豆肉汤(tryptic soy broth, TSB)洗下斜面24 h新鲜培养物,再用TSB稀释成试验需要的菌悬液,以保证试验期间菌悬液的菌量。在脱脂白平纹棉片(1.0 cm×1.0 cm)和灭菌牛皮纸(5 cm×5 cm)上滴染各菌TSB菌悬液,干燥后制成菌片,使回收菌量为5×105~5×106 CFU/片,将干燥后的菌片于-10、-20℃条件下放置30 min备用。按《低温消毒剂卫生安全评价技术要求》[9]中的操作步骤制备病毒悬液。
1.2.2 试验分组根据该复方过氧化物消毒剂的使用说明,分成三组进行试验。A组:将复方过氧化物消毒剂母液稀释50倍,并加入同等体积的防冻液,使过氧乙酸和过氧化氢的终浓度分别为580、2 450 mg/L,置于-20℃医用冷藏冷冻箱内15 h,备用;B组:将复方过氧化物消毒剂母液稀释100倍,稀释后的消毒剂与防冻液7 ∶3配制,使过氧乙酸和过氧化氢的终浓度分别为400、1 720 mg/L,置于-10℃医用冷藏冷冻箱内15 h,备用;C组:复方过氧化物消毒剂母液稀释1 000倍,不加防冻液,使过氧乙酸和过氧化氢的终浓度分别为60、249 mg/L。A组、B组消毒剂,分别置于-20、-10℃医用冷藏冷冻箱内15 h后,均保持液体状态,无析出、无结晶。
1.2.3 定量杀菌试验A组、B组和C组消毒剂采用载体浸泡定量杀菌试验方法,以规格为1.0 cm×1.0 cm的脱脂平纹白棉布片为载体,A组和B组消毒剂定量杀菌试验分别在-10、-20 ℃的恒温水浴锅中进行。将5 mL消毒剂加入无菌容器中并放置于恒温水浴槽中,随后将菌片置入消毒剂中并计时,以标准硬水为阳性对照组。作用一定时间后将菌片取出并投入中和剂试管中经充分洗脱,活菌计数培养并计算杀灭对数值。C组消毒剂在常温下采用载体法进行定量杀菌试验。每组试验重复3次。
1.2.4 脊髓灰质炎病毒灭活试验A、B两组消毒剂采用载体法进行病毒灭活试验。按照《消毒技术规范》[8]要求,将100 μL脊髓灰质炎病毒悬液与3%小牛血清白蛋白100 μL充分混合,分别放置于-20、-10℃水浴中,恒温孵育5 min,随后再加入消毒剂800 μL均匀混合。达到作用时间后取100 μL加至900 μL 10 g/L硫代硫酸钠的MEM溶液中,作用10 min,进行10倍系列梯度稀释,将最终样液接种Vero细胞、阳性对照和阴性对照一并培养,观察并记录细胞病变情况,计算灭活对数值。C组消毒剂在常温下采用悬液法进行病毒灭活试验。
1.2.5 消毒模拟现场试验以灭菌的牛皮纸(5 cm×5 cm)为染菌载体。按照《消毒技术规范》[8]要求,对物体表面进行消毒模拟现场试验,A组和B组消毒剂试验温度分别为-20、-10℃。将冷链货物纸箱放置于-10、-20℃冰柜24 h以上,随后取出,将染菌载体固定于纸箱的6个表面并放入冰柜中。将A组和B组消毒剂装入手持式喷壶中,在冰柜内对上述纸箱的各个表面进行喷雾消毒,作用10 min后,将纸箱上的载体取下进行活菌培养计数。
1.2.6 急性经口毒性试验按照《消毒技术规范》[8]要求,对消毒剂开展安全性评价。试验用无特定病原体动物(SPF)级昆明种小鼠20只,雌雄各半。每只小鼠以0.2 mL/10 g的剂量灌胃该消毒剂,灌胃前动物禁食过夜。在小鼠灌胃1 h后正常饮食;观察小鼠14 d,记录小鼠每日中毒症状及死亡情况,计算半数致死量(LD50)。
1.2.7 皮肤刺激试验试验用新西兰白色家兔3只,雌性,在试验24 h前剃除家兔背部脊柱两侧的毛,提供2块去毛区域。将0.5 mL复方过氧化物消毒剂涂抹于家兔左侧去毛区域皮肤上,然后用斑贴覆盖,再用无刺激性胶布和绷带加以固定。另一侧去毛区域皮肤斑贴覆盖作为对照。贴敷4 h后,用温水对残留受试物进行清除。在清除受试物后1、24、48 h观察受试部位皮肤反应,对皮肤刺激反应进行评分。
1.2.8 小鼠骨髓嗜多染红细胞微核试验试验用SPF级昆明种小鼠50只,雌雄各半,将复合过氧化物消毒剂按0.2 mL/10 g的剂量对小鼠进行灌胃,每只两次,间隔24 h,灌胃6 h后处死小鼠同时取股骨、剥去肌肉,将股骨两端去除,小牛血清冲洗涂片后用甲醇固定,再用Giemsa染液染色。观察每只小鼠,对每只小鼠的1 000个完整骨髓嗜多染红细胞(PCE)进行微核计数,计算对应细胞微核率;计算PCE/正染红细胞(NCE)比例。
2 结果 2.1 定量杀菌试验结果A组消毒剂在-20℃恒温下,作用5、10、15 min,对大肠埃希菌的平均杀灭对数值均为6.15,对金黄色葡萄球菌的平均杀灭对数值均为6.21;B组消毒剂在-10℃恒温下,作用5、10、15 min,对大肠埃希菌的平均杀灭对数值均为6.25,对金黄色葡萄球菌的平均杀灭对数值均为6.36;C组消毒剂在20℃恒温下,作用5、10、15 min,对大肠埃希菌的平均对数值均为6.44,对金黄色葡萄球菌的平均杀灭对数值均为6.45。
2.2 脊髓灰质炎病毒灭活试验结果A组消毒剂在-20℃恒温下,作用20 min,对脊髓灰质炎病毒的平均灭活对数值为6.05;B组消毒剂在-10℃恒温下,作用20 min,对脊髓灰质炎病毒的平均灭活对数值为5.89;C组消毒剂在20℃恒温下,作用10 min,对脊髓灰质炎病毒的平均灭活对数值为5.50,见表 1。
| 表 1 各组消毒剂对脊髓灰质炎病毒的灭活效果 Table 1 Inactivation effect of each disinfectant group on poliovirus |
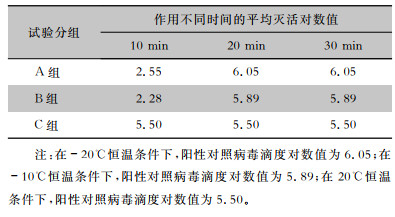
|
在-20℃恒温下,A组消毒剂作用10 min,对染于牛皮纸上的大肠埃希菌和金黄色葡萄球菌的平均杀灭对数值分别为5.82、5.76;在-10℃恒温下,B组消毒剂作用10 min,对染于牛皮纸上的大肠埃希菌和金黄色葡萄球菌的平均杀灭对数值分别为5.73、5.48。大肠埃希菌阳性对照组菌落数为(5.42×105~4.58×106) CFU/cm2,平均为3.22×106 CFU/cm2;金黄色葡萄球菌阳性对照组菌落数为(5.22×105~4.80×106) CFU/cm2,平均为3.40×106 CFU/cm2。
2.4 安全性评价结果急性经口毒性试验的结果显示,在5 000 mg/kg的剂量下该复方过氧化物消毒剂对所有小鼠(共20只)体重无明显影响,死亡动物数为0。即该消毒剂LD50>5 000 mg/kg,属实际无毒级物质。皮肤刺激试验的结果显示,该复方过氧化物消毒剂在1、24、48 h情况下均未观察到对家兔皮肤造成红斑、水肿刺激反应,刺激指数为0,提示对家兔皮肤无刺激性。不同剂量复方过氧化物消毒剂对小鼠骨髓嗜多染红细胞微核试验结果的PCE/NCE值见表 2,1 250、2 500、5 000 mg/kg剂量组与阴性对照组比较,差异均无统计学意义(均P>0.05),提示该复方过氧化物消毒剂对昆明种小鼠体内染色体无明显损伤作用。
| 表 2 小鼠骨髓嗜多染红细胞微核试验结果 Table 2 Micronucleus test results on polychromatic erythrocytes in mice bone marrow |
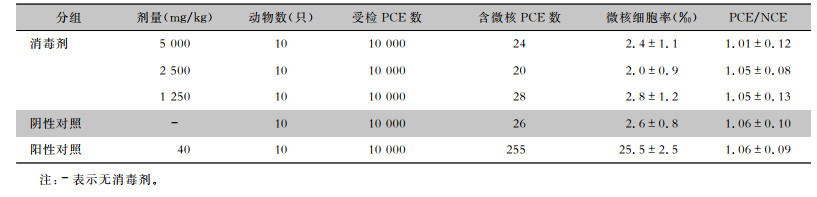
|
本研究结果表明,复方过氧乙酸消毒剂与防冻剂组合后在-20、-10℃下对大肠埃希菌、金黄色葡萄球菌作用5 min,对脊髓灰质炎病毒作用20 min,杀灭对数值均>3,均符合消毒要求。安全性评价结果表明该消毒剂对小鼠急性经口毒性、家兔皮肤、小鼠体内染色体均无明显损伤作用,属于安全无毒级消毒剂。
过氧乙酸是一种对各种微生物均有杀灭作用的高效消毒剂,在消毒后无残留毒性,不会对周围环境造成二次污染,被称为最清洁的消毒剂[10-11]。过氧乙酸若单独使用不仅刺激性强,腐蚀性大,而且不稳定[7]。因此,采用过氧乙酸和过氧化氢组合复方使用,降低过氧乙酸的使用剂量,以降低其腐蚀性[12]。同时研究表明过氧乙酸能与过氧化氢在杀菌过程中具有协同作用,同时提高过氧乙酸稳定性[12]。本研究采用的过氧乙酸复方消毒剂为过氧乙酸和过氧化氢组合,含量比例约为1 ∶5的复方过氧乙酸消毒剂。本研究阐明复方过氧化物消毒剂在常温下对细菌或病毒均具有良好的消毒效果,可应用于大部分环境下的消毒,属于高效、广谱消毒剂。
低温消毒剂需要通过低温试验以确保其在低温下不凝固及稳定性,并且能够在物体表面达到合格的消毒效果[6, 13]。因此常通过加入防冻剂降低冰点。已有部分研究显示,常用的化学类消毒剂如季铵盐类[14]、含氯消毒剂[15-16]、醛类消毒剂[17]、过氧化氢消毒剂[18]等在加入相应的防冻剂后均能发挥良好的消毒效果,且已有低温消毒剂产品研制成功[19]。本研究通过杀菌效果、杀病毒效果,以及模拟现场消毒效果的系列试验表明,低温下该复方过氧乙酸消毒剂与包含甘油、丙醇的防冻剂组合可有效杀灭细菌繁殖体、病毒等,能达到合格的消毒效果。此在一定程度上扩大了过氧化物类消毒剂的适用范围,且该复方过氧乙酸消毒剂安全无毒性,便于储存和运输,克服了寒冷地区冬季消毒的困难,不但适用于冷链货物外包装消毒,也适用于冬季卫生防疫室外消毒,对我国冬季消毒有现实性意义,具有较为广阔的应用前景。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Pang XH, Ren LL, Wu SS, et al. Cold-chain food contamination as the possible origin of COVID -19 resurgence in Beijing[J]. Natl Sci Rev, 2020, 7(12): 1861-1864. DOI:10.1093/nsr/nwaa264 |
| [2] |
Dyal JW, Grant MP, Broadwater K, et al. COVID -19 among workers in meat and poultry processing facilities-19 states, April 2020[J]. MMWR Morb Mortal Wkly Rep, 2020, 69(18): 557-561. |
| [3] |
McKenney H. Positive COVID -19 results grow to 92 aboard factory trawler[EB/OL]. (2020-06-04)[2022-06-03]. https://www.kucb.org/health/2020-06-04/positive-covid-19-results-grow-to-92-aboard-factory-trawler.
|
| [4] |
张子衿, 孙红霞, 赵建利. 低温消毒液的发展现状及应用[J]. 中国洗涤用品工业, 2022(3): 34-37. Zhang ZJ, Sun HX, Zhao JL. Evelopment status and application of low temperature disinfectant[J]. China Cleaning Industry, 2022(3): 34-37. |
| [5] |
Chi YH, Wang QX, Chen GS, et al. The long-term presence of SARS-CoV-2 on cold-chain food packaging surfaces indicates a new COVID -19 winter outbreak: a mini review[J]. Front Public Health, 2021, 9: 650493. DOI:10.3389/fpubh.2021.650493 |
| [6] |
食品安全标准与监测评估司. 关于印发冷链食品生产经营新冠病毒防控技术指南和冷链食品生产经营过程新冠病毒防控消毒技术指南的通知[EB/OL]. (2020-10-22)[2022-09-20]. http://www.nhc.gov.cn/sps/s7887k/202010/ff228979f1534c3abca56559f14ea115.shtml. Department of Food Safety Standards, Monitoring and Evaluation. Notice on printing and distributing technical guidelines for the prevention and control of COVID -19 in cold chain food-production and operation and technical guidelines for the prevention and control of COVID -19 in cold chain food production and operation[EB/OL]. (2020-10-22)[2022-09-20]. http://www.nhc.gov.cn/sps/s7887k/202010/ff228979f1534c3abca56559f14ea115.shtml. |
| [7] |
陈微娜, 杨晶雪, 范准, 等. 一种复方过氧化物消毒剂消毒性能研究[J]. 中国消毒学杂志, 2021, 38(1): 7-9, 12. Chen WN, Yang JX, Fan Z, et al. Evaluation of the main properties of a compound peroxide disinfectant[J]. Chinese Journal of Disinfection, 2021, 38(1): 7-9, 12. |
| [8] |
中华人民共和国卫生部. 消毒技术规范[S]. 北京. 2002. Ministry of Health of the People's Republic of China. Technical standard for disinfection[S]. Beijing, 2002. |
| [9] |
中华人民共和国国家卫生健康委员会综合监督局. 国家卫生健康委办公厅关于印发低温消毒剂卫生安全评价技术要求的通知: 国卫办监督函[2020]1062号[EB/OL]. (2020-12-31)[2022-09-20]. http://www.nhc.gov.cn/zhjcj/s9141/202101/6bd3e2837e944505bb55d9cb42a8e233.shtml. General Supervision Bureau of the National Health Commission of the People's Republic of China. Notice of the general office of the national health commission on printing and distribu- ting the technical requirements for hygienic safety assessment of low-temperature disinfectants: supervision letter of the national health office[2020] No. 1062[EB/OL]. (2020-12-31)[2022-09-20]. http://www.nhc.gov.cn/zhjcj/s9141/202101/6bd3e2837e944505bb55d9cb42a8e233.shtml. |
| [10] |
殷社, 谢兴隆, 魏少东, 等. 过氧乙酸消毒剂性能研究和探讨[J]. 中国洗涤用品工业, 2020(3): 80-84. Yin S, Xie XL, Wei SD, et al. Study on the performance of peracetic acid disinfectant[J]. China Cleaning Industry, 2020(3): 80-84. DOI:10.3969/j.issn.1672-2701.2020.03.014 |
| [11] |
陈明中, 吴心勤, 蔺红光. 过氧乙酸消毒液的毒理学评价[J]. 预防医学论坛, 2007, 13(4): 338-339. Chen MZ, Wu XQ, Lin HG. Toxicological evaluation on pera-cetic acid[J]. Preventive Medicine Tribune, 2007, 13(4): 338-339. |
| [12] |
Leggett MJ, Schwarz JS, Burke PA, et al. Mechanism of sporicidal activity for the synergistic combination of peracetic acid and hydrogen peroxide[J]. Appl Environ Microbiol, 2016, 82(4): 1035-1039. DOI:10.1128/AEM.03010-15 |
| [13] |
Liu JT, Zheng TZ, Xia W, et al. Cold chain and severe acute respiratory syndrome coronavirus 2 transmission: a review for challenges and coping strategies[J]. Med Rev (Berl), 2022, 2(1): 50-65. |
| [14] |
陈海兰, 刘心建. 十二烷基二甲基苄基氯化铵的低温杀菌效果[J]. 中国洗涤用品工业, 2021(3): 45-47. Chen HL, Liu XJ. Observation on low temperature sterilization effect of dodecyl dimethyl benzyl ammonium chloride[J]. China Cleaning Industry, 2021(3): 45-47. |
| [15] |
刘涛, 雷思勤, 王跃进. 含氯消毒剂抗冻剂的研究[J]. 中国消毒学杂志, 2008, 25(4): 377-379. Liu T, Lei SQ, Wang YJ. Research on antifreezing compounds for the chlorine-containing disinfectants[J]. Chinese Journal of Disinfection, 2008, 25(4): 377-379. |
| [16] |
胡佳, 蔡慧玲, 赖翠玲, 等. 次氯酸消毒剂低温消毒效果试验观察[J]. 中国口岸科学技术, 2021, 3(6): 15-19. Hu J, Cai HL, Lai CL, et al. Experimental observation on low-temperature disinfection effect of hypochlorous acid disinfectants[J]. China Port Science and Technology, 2021, 3(6): 15-19. |
| [17] |
郝大成. 低温条件下戊二醛复合消毒剂的筛选及其对运载车辆的消毒效果研究[D]. 呼和浩特: 内蒙古农业大学, 2019. Hao DC. Studies on screening of glutaraldehyde compound disinfectant and its disinfection effects under low temperature conditions on transport vehicles[D]. Hohhot: Inner Mongolia Agricultural University, 2019. |
| [18] |
魏兰芬, 潘协商, 李晔, 等. 某强化过氧化氢消毒液在低温下的消毒效果研究[J]. 中国消毒学杂志, 2020, 37(12): 894-895, 900. Wei LF, Pan XS, Li Y, et al. Disinfection effect of an enhanced hydrogen peroxide disinfectant at low temperature[J]. Chinese Journal of Disinfection, 2020, 37(12): 894-895, 900. |
| [19] |
中国疾病预防控制中心. 中国疾病预防控制中心成功研发两种含氯低温消毒剂配方[EB/OL]. (2021-02-07)[2022-09-30]. https://www.chinacdc.cn/yw_9324/202102/t20210207_224133.html. China CDC. Chinese Center for Disease Control and Prevention successfully develops two formulations of chlorine-containing low-temperature disinfectants[EB/OL]. (2021-02-07)[2022-09-30]. https://www.chinacdc.cn/yw_9324/202102/t20210207_224133.html. |



