2. 安徽省肿瘤医院 中国科学技术大学附属第一医院西区 安徽省立医院西区呼吸肿瘤内科, 安徽 合肥 230071
2. Department of Respiratory Oncology, Anhui Provincial Cancer Hospital, The First Affiliated Hospital of USTC West District, Anhui Provincial Hospital West District, Hefei 230071, China
出芽短梗霉(Aureobacidium pullulans)是一种在自然界中普遍存在的暗色酵母样真菌,可以寄居在人的头发和皮肤上。临床表明,出芽短梗霉可导致皮肤和软组织感染、脑膜炎、肺真菌病、脾脓肿和腹膜炎等[1]。作为一种条件致病菌,在正常免疫力患者中感染极其罕见,国内外报道更不多见。本文报告一例免疫功能正常年轻女性患者感染出芽短梗霉病例。
1 病历资料患者女性,26岁,教师,体重45 kg,安徽铜陵人,因“咳嗽20余天”于2022年4月12日入院。患者20余天前受凉后出现咳嗽,干咳为主,无发热,无胸闷,有左侧胸痛,自服枇杷膏及阿莫西林胶囊,症状未见改善,故于某院急诊就诊,行胸部CT示:左肺下叶见多发斑点状、斑片状及团片状高密度影,边界模糊,密度不均,余两肺未见明显实质性病变,呼吸科遂拟“社区获得性肺炎(非重症)”收住入院。入院查体:心、肺、腹部查体未见异常,全身未扪及肿大淋巴结。入科查血常规示白细胞11.28×109/L,中性粒细胞7.74×109/L,C反应蛋白(CRP)5.85 mg/L,血红蛋白、肝肾功能、电解质、血糖、血脂、甲状腺功能、凝血功能、T细胞亚群、粪便常规+隐血、尿常规、血沉、1, 3-β-D葡聚糖试验(G实验)均未见异常。结核感染特异性T细胞检测(T-SPOT)试验、自身抗体谱、痰培养及多次痰标本抗酸杆菌检测、半乳甘露聚糖抗原(GM)试验、新生隐球菌荚膜抗原测定、电子支气管镜取肺泡灌洗液行细菌及真菌培养结果均为阴性。呼吸科先后予以头孢他啶、莫西沙星抗感染治疗后复查胸部CT见病灶未见吸收改变,见图 1。遂再次行电子支气管镜肺泡灌洗液宏基因组二代测序(mNGS)检查。结果示总序列数39 631 911,短梗霉属(序列数15 921),出芽短梗霉生长(序列数15 082,相对丰度82.57%),人类α疱疹病毒1型(HSV1,序列数3,相对丰度50%);而细菌、结核分枝杆菌复合群、寄生虫、支原体、衣原体、立克次体均未发现。遂调整方案,停用其他药物,行伏立康唑单药抗真菌治疗,负荷剂量270 mg,每日2次,24 h后200 mg,每日2次,静脉输注10 d后过渡为口服200 mg,每日2次维持治疗,2个月后复查胸部CT见左肺下叶病灶显著吸收,见图 2。
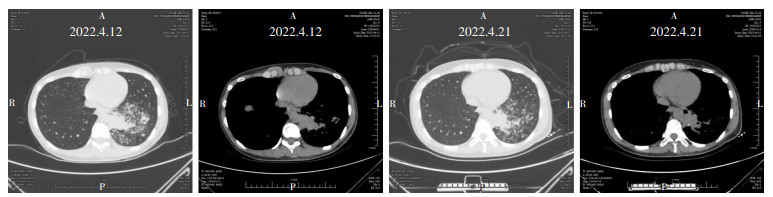 |
| 图 1 患者经抗感染治疗前胸部CT情况 Figure 1 Patient's chest CT examination result before anti-infection treatment |
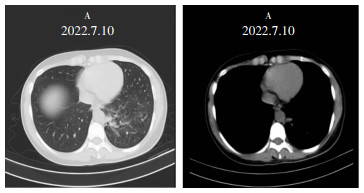 |
| 图 2 患者经抗真菌治疗后胸部CT情况 Figure 2 Patient's chest CT examination result after antifungal therapy |
分别以“Aureobasidium pullulans”和“出芽短梗霉”为关键词,在PubMed、中国知网(CNKI)、万方数据库、维普中文科技期刊数据库及中国生物医学文献数据库中检索文献,筛查并剔除资料不全、重复发表的文献。收集并记录临床资料,包括作者、患者性别、年龄、基础疾病或高危感染因素、感染部位、诊断方式、治疗方案及预后等。
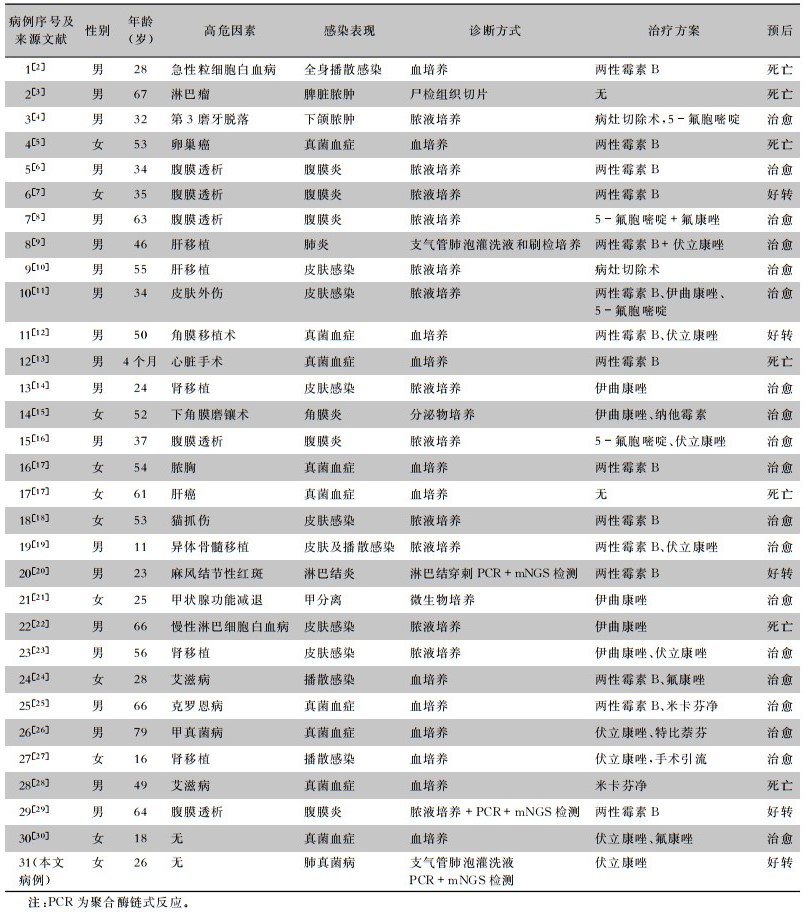
共检索出芽短梗霉所致感染报道30例,结合本例患者,共31例,其中男性20例,女性11例,年龄4个月~79岁,2例患者免疫功能正常,无感染高危因素,余有基础疾病、继发性免疫抑制、外伤、移植等病史。包括:(1)血液系统疾病3例,分别为急性粒细胞白血病、淋巴瘤及慢性淋巴细胞白血病;(2)器官移植6例,分别为肝移植、角膜移植、肾移植;(3)腹膜透析5例;(4)肿瘤2例,分别为卵巢癌、肝癌;(5)外伤2例,分别为猫抓伤及皮肤外伤;(6)免疫缺陷2例,均为艾滋病;(7)有基础疾病3例,分别为甲状腺功能减退、克罗恩病、麻风病;(8)1例心脏手术患者。其中,所致肺部真菌感染仅国外1例报道(病例8),国内尚无。临床表现无特异性,主要与受累系统相关。所统计的文献中9例为真菌血症,5例腹膜炎,7例皮肤感染,4例播散感染,2例肺炎,余为局部脓肿。经抗真菌治疗好转及痊愈24例,7例死亡。见表 1。
| 表 1 31例出芽短梗霉感染病例报道汇总 Table 1 Literature reports summary of 31 cases of A. pullulans infection |
|
出芽短梗霉是一种暗色酵母样腐生真菌,以细胞中存在黑色素为特征,又称为黑色酵母。出芽短梗霉是自然环境中一种广泛分布的腐生真菌,通常可从植物残骸、土壤、木材、纺织品和浴帘中分离出来,亦可定植于人类的头发和皮肤[29]。其耐热性差,最宜生长温度为25℃,在人体上相对生长受限,故致病能力并不强,是一种条件致病菌,主要是产生的黑色素沉积于细胞壁上,成为其主要毒力因子,可以抑制宿主免疫系统的吞噬作用,清除效应细胞产生的过氧化物和其他氧化物。
病原菌的培养、直接镜检、病理学检查是诊断出芽短梗霉感染的主要传统检测方法。在笔者收集的文献中,其中14例通过脓液培养或分泌物培养,12例通过血培养,1例支气管肺泡灌洗液和刷检培养明确,1例淋巴结组织活检病理及PCR+mNGS检测,1例脓液培养+PCR+mNGS检测及1例为尸检组织切片病理明确。出芽短梗霉在沙氏葡萄糖琼脂(SDA)培养基、玉米粉琼脂(CMA)等培养基中均可见菌落生长,一般培养2周左右时开始生长,菌落初始表现为淡粉色或奶油色,随着时间的推移,菌落逐渐变成深棕色直至黑色。但其生长受较多因素影响,如碳源、温度、菌落年龄、底物、pH值等,造成其诊断非常困难,同时对试验人员的技术和经验也是一大考验,常常被误认为是标本污染。随着医学的进步,基于宏基因组学检测技术的发展,分子生物学检测方法将是一种非常有潜力的替代方案。通过对内转录区(ITS)和26S rDNA基因的D1/D2区的PCR扩增及测序可实现准确的分子生物学鉴定。本文报告病例即属典型,该患者无明确外伤史,有肺部影像学改变,可能源于呼吸道感染。出芽短梗霉感染的影像学检查亦不具有特征性,主要跟感染的部位相关。在Tan等[9]所报道的1例肺部感染患者中,患者肺部CT表现为双肺弥漫的高密度影,提示炎症浸润,与本例患者肺部CT所示左肺下叶多发斑点状、斑片状及团片状高密度影相似。与普通细菌性肺炎或结核分枝杆菌感染影像学表现难以区分。
据报道,出芽短梗霉会引起多种局部感染,包括腹膜炎(腹膜透析患者)、皮肤感染、肺炎、脑膜炎、角膜和巩膜感染、脾脏、颌骨脓肿以及全身感染等。由于出芽短梗霉致病能力有限,临床感染很少见,主要影响免疫功能低下的人群[31]。但本例患者是一例免疫功能正常患者,无任何基础疾病,未居住在潮湿发霉环境中,且为年轻女性,最初行mNGS检测出出芽短梗霉一度考虑污染可能,但患者经正规抗感染治疗后,复查胸影像学检查病灶未见吸收改变,鉴于该患者出芽短梗霉序列数(15 082)及相对丰度(82.57%)明显偏高,考虑具有临床意义,检索国内外出芽短梗霉感染相关治疗指南及相关文献,未检索出治疗指南,同时治疗方案不统一,但抗真菌治疗仍是其主要治疗手段,有皮肤感染者需行病灶切除术[10],局部脓肿者可行引流术[27],有单独使用抗真菌药物,亦有联合使用者,已发表的文献报道中,两性霉素B、伏立康唑、伊曲康唑、氟康唑均已成功用于治疗出芽短梗霉感染;但也有部分患者使用伊曲康唑、两性霉素B、米卡芬净后仍未好转,最终死亡。1997年Tan等[9]报道的1例肝移植患者发生真菌肺炎使用两性霉素B联合伏立康唑治疗,该患者最终治愈。本文报告病例无基础疾病,遂采用静脉注射伏立康唑(首剂6 mg/kg,每日2次;维持4 mg/kg,每日2次)单一药物抗真菌治疗,同时监测患者肝、肾功能。患者肝、肾功能未见明显损伤,规律用药,2个月后复查胸部CT可见左肺下叶病灶显著吸收。
近年来,随着恶性肿瘤、恶性血液病的高发病率,高强度的免疫抑制剂及化学治疗药物的应用,实体器官移植的广泛开展,各种导管的体内介入和留置等,肺真菌感染发病率明显上升,临床工作中早期发现严重感染患者的致病微生物至关重要,可为医务人员提供准确信息,从而给予适当有效的抗菌药物进行治疗。但是,对于许多住院患者,由于大多数疾病呈现出难以区分的临床表现,即同症不同病,同病不同症,因此,很难及时准确的进行诊断。目前我们迫切需要基础、广泛的多重诊断测试,但对于绝大多数潜在病原体尚不可用。一些微生物是不可培养或培养条件较苛刻(如支原体、军团菌),而其他(如分枝杆菌、霉菌)可能需要数周时间才能生长和形成菌落[32]。准确的通过PCR进行分子检测为培养提供了另一种诊断方法。本文报告的病例即是通过mNGS检测提取感染标本中全部微生物的核酸,经过不同的标本前处理,在高通量测序平台上进行测序,通过高质量、高标准临床级别数据库(plant metabolome database,PMDB)比对和智能生信分析算法,获得疑似致病微生物的种属信息。研究[32]报道,mNGS对细菌检测的灵敏度为81%~86%,特异度为91%~95%,对真菌检测的灵敏度为63%~70%,特异度为92%~96%,快速mNGS检测作为未知感染的临床诊断工具具有重要意义,同时临床医生需提高对疾病的认知,做出合理判断。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Alami S, Sekkal I, Aoufi S, et al. Subcutaneous phaeohyphomycosis caused by Aureobasidium pullulans in an immunocompetent carpenter[J]. Med Mycol Case Rep, 2022, 36: 1-4. DOI:10.1016/j.mmcr.2022.02.003 |
| [2] |
Kaczmarski EB, Liu Yin JA, Tooth JA, et al. Systemic infection with Aureobasidium pullulans in a leukaemic patient[J]. J Infect, 1986, 13(3): 289-291. DOI:10.1016/S0163-4453(86)91388-5 |
| [3] |
Salkin IF, Martinez JA, Kemna ME. Opportunistic infection of the spleen caused by Aureobasidium pullulans[J]. J Clin Microbiol, 1986, 23(5): 828-831. DOI:10.1128/jcm.23.5.828-831.1986 |
| [4] |
Koppang HS, Olsen I, Stuge U, et al. Aureobasidium infection of the jaw[J]. J Oral Pathol Med, 1991, 20(4): 191-195. DOI:10.1111/j.1600-0714.1991.tb00920.x |
| [5] |
Girardi LS, Malowitz R, Tortora GT, et al. Aureobasidium pullulans septicemia[J]. Clin Infect Dis, 1993, 16(2): 338-339. |
| [6] |
Clark EC, Silver SM, Hollick GE, et al. Continuous ambulatory peritoneal dialysis complicated by Aureobasidium pullulans peritonitis[J]. Am J Nephrol, 1995, 15(4): 353-355. DOI:10.1159/000168863 |
| [7] |
Caporale NE, Calegari L, Perez D, et al. Peritoneal catheter colonization and peritonitis with Aureobasidium pullulans[J]. Perit Dial Int, 1996, 16(1): 97-98. DOI:10.1177/089686089601600129 |
| [8] |
Ibañez Perez R, Chacón J, Fidalgo A, et al. Peritonitis by Aureobasidium pullulans in continuous ambulatory peritoneal dialysis[J]. Nephrol Dial Transplant, 1997, 12(7): 1544-1545. DOI:10.1093/ndt/12.7.1544 |
| [9] |
Tan HP, Wahlstrom HE, Zamora JU, et al. Aureobasidium pneumonia in a post liver transplant recipient: a case report[J]. Hepatogastroenterology, 1997, 44(16): 1215-1218. |
| [10] |
Redondo-Bellón P, Idoate M, Rubio M, et al. Chromoblastomycosis produced by Aureobasidium pullulans in an immunosuppressed patient[J]. Arch Dermatol, 1997, 133(5): 663-664. DOI:10.1001/archderm.1997.03890410127025 |
| [11] |
Paredes CJ, Del Gordo EC, Torrado E, et al. Chronic septal panniculitis caused by phaeohyphomycosis[J]. J Clin Rheumatol, 1998, 4(6): 323-327. |
| [12] |
Gupta V, Chawla R, Sen S. Aureobasidium pullulans scleritis following keratoplasty: a case report[J]. Ophthalmic Surg Lasers, 2001, 32(6): 481-482. DOI:10.3928/1542-8877-20011101-10 |
| [13] |
Hawkes M, Rennie R, Sand C, et al. Aureobasidium pullulans infection: fungemia in an infant and a review of human cases[J]. Diagn Microbiol Infect Dis, 2005, 51(3): 209-213. DOI:10.1016/j.diagmicrobio.2004.10.007 |
| [14] |
Arranz Sánchez DM, de la Calle MC, Martín-Díaz MA, et al. Subcutaneous mycosis produced by Aureobasidium pullulans in a renal transplant recipient[J]. J Eur Acad Dermatol Venereol, 2006, 20(2): 229-230. DOI:10.1111/j.1468-3083.2006.01385.x |
| [15] |
Maverick KJ, Conners MS. Aureobasidium pullulans fungal keratitis following LASEK[J]. J Refract Surg, 2007, 23(7): 727-729. DOI:10.3928/1081-597X-20070901-15 |
| [16] |
Mise N, Ono Y, Kurita N, et al. Aureobasidium pullulans peritonitis: case report and review of the literature[J]. Perit Dial Int, 2008, 28(6): 679-681. DOI:10.1177/089686080802800626 |
| [17] |
Huang YT, Liaw SJ, Liao CH, et al. Catheter-related septicemia due to Aureobasidium pullulans[J]. Int J Infect Dis, 2008, 12(6): e137-e139. DOI:10.1016/j.ijid.2008.02.004 |
| [18] |
Pikazis D, Xynos ID, Xila V, et al. Extended fungal skin infection due to Aureobasidium pullulans[J]. Clin Exp Dermatol, 2009, 34(8): e892-e894. DOI:10.1111/j.1365-2230.2009.03663.x |
| [19] |
Joshi A, Singh R, Shah MS, et al. Subcutaneous mycosis and fungemia by Aureobasidium pullulans: a rare pathogenic fungus in a post allogeneic BM transplant patient[J]. Bone Marrow Transplant, 2010, 45(1): 203-204. DOI:10.1038/bmt.2009.111 |
| [20] |
de Morais OO, Porto C, Coutinho ASSL, et al. Infection of the lymphatic system by Aureobasidium pullulans in a patient with erythema nodosum leprosum[J]. Braz J Infect Dis, 2011, 15(3): 288-292. |
| [21] |
Arabatzis M. Hypothyroidism-related onycholysis with Aureobasidium pullulans colonization successfully treated with antifungal therapy[J]. Clin Exp Dermatol, 2012, 37(4): 370-373. DOI:10.1111/j.1365-2230.2012.04347.x |
| [22] |
de Oliveira LR, Moraes-Souza H, Maltos AL, et al. Aureobasidium pullulans infection in a patient with chronic lymphocytic leukemia[J]. Rev Soc Bras Med Trop, 2013, 46(5): 660-662. DOI:10.1590/0037-8682-0117-2013 |
| [23] |
Eswarappa M, Varma PV, Madhyastha R, et al. Unusual fungal infections in renal transplant recipients[J]. Case Rep Transplant, 2015, 2015: 292307. |
| [24] |
van Hougenhouck-Tulleken WG, Mathole G, Karstaedt A, et al. Disseminated fungal infection in an HIV-infected patient due to Aureobasidium pullulans[J]. South Afr J Infect Dis, 2016, 31(3): 71-73. |
| [25] |
Mehta SR, Johns S, Stark P, et al. Successful treatment of Aureobasidium pullulans central catheter-related fungemia and septic pulmonary emboli[J]. IDCases, 2017, 10: 65-67. DOI:10.1016/j.idcr.2017.08.017 |
| [26] |
李东明, 周亚斌, 关欣, 等. 疑难病例析评第411例高热—脓疱—白细胞异常增多[J]. 中华医学杂志, 2017, 97(33): 2625-2628. Li DM, Zhou YB, Guan X, et al. Analysis of difficult cases--the 411th case hyperthermia-pustules-abnormal leukocytes[J]. National Medical Journal of China, 2017, 97(33): 2625-2628. DOI:10.3760/cma.j.issn.0376-2491.2017.33.015 |
| [27] |
Nalcacioglu H, Yakupoglu YK, Genc G, et al. Disseminated fungal infection by Aureobasidium pullulans in a renal transplant recipient[J]. Pediatr Transplant, 2018, 22(3): e13152. DOI:10.1111/petr.13152 |
| [28] |
Mittal J, Szymczak WA, Pirofski LA, et al. Fungemia caused by Aureobasidium pullulans in a patient with advanced AIDS: a case report and review of the medical literature[J]. JMM Case Rep, 2018, 5(4): e005144. |
| [29] |
Chamroensakchai T, Leedumrongwattanakul K, Takkava-takarn K, et al. Peritoneal dialysis (PD) catheter-related peritonitis from Aureobasidium pullulans caused by poor caregi-ver's hand hygiene[J]. Med Mycol Case Rep, 2019, 25: 35-38. DOI:10.1016/j.mmcr.2019.07.005 |
| [30] |
张晓丽, 叶慧, 卢家桀, 等. 出芽短梗霉病1例报道并文献复习[J]. 中国感染与化疗杂志, 2019, 19(6): 621-626. Zhang XL, Ye H, Lu JJ, et al. Infection caused by Aureobasi-dium pullulans: one case report and literature review[J]. Chinese Journal of Infection and Chemotherapy, 2019, 19(6): 621-626. DOI:10.16718/j.1009-7708.2019.06.008 |
| [31] |
Gu W, Deng XD, Lee M, et al. Rapid pathogen detection by metagenomic next-generation sequencing of infected body fluids[J]. Nat Med, 2021, 27(1): 115-124. DOI:10.1038/s41591-020-1105-z |
| [32] |
Rea B, Maisel JR, Glaser L, et al. Identification of clinically relevant mycobacterial species after extended incubation times in the BACTEC MGIT system[J]. Am J Clin Pathol, 2019, 151(1): 63-67. |



