2. 中南大学湘雅三医院药学部, 湖南 长沙 410013
2. Department of Pharmacy, The Third Xiangya Hospital, Central South University, Changsha 410013, China
脓毒症是严重危害健康的疾病,具有高发病率和高病死率的特点,在2017年全球共发生4 890万例脓毒症病例,与脓毒症相关的死亡病例达到1 100万,占全球死亡数的19.7%[1]。一项对我国重症监护病房(ICU)脓毒症流行病学的全国横断面调查显示,中国大陆五分之一的ICU患者会遭受脓毒症困扰,其90天病死率高达35.5%[2]。脓毒症的临床救治仍然是危及全球的健康挑战,世界卫生组织(WHO)将其列为“全球医疗优先关注的疾病”[3]。研究[4]表明更早的识别到脓毒症和抗菌药物使用有利于改善患者生存。脓毒症的早期预警系统与改善患者的预后密切相关。
控制急性脓毒血症和脓毒症休克的推荐措施之一就是尽早进行血培养[5],但是血培养目前存在的问题是检测周期长和阳性率低[6]。检测周期长的主要原因是血流感染的细菌载量很低,阳性率低很多时候与患者已经使用了抗菌药物、血中存在抑菌物质有关[7]。尽管指南推荐的是在抗菌药物使用之前采血标本进行血培养,但是临床上更常见的是在采血标本前已经按照经验治疗使用了抗菌药物。为了解决这个问题,科学家们对血培养的培养基和血培养检测仪器等不断进行优化,如在培养基中添加可以吸附抗菌药物的树脂或活性炭,利用自动化仪器恒温、振摇和实时监测血培养情况[8]。
BACT/ALERT VIRTUO是梅里埃公司最新推出的一款血培养检测系统,血培养瓶为FA plus需氧瓶(FA+)和FN plus厌氧瓶(FN+),均含有多聚吸附珠。BACT/ALERT VIRTUO联用FA+、FN+培养瓶对血培养病原菌的检出,尤其是在使用抗菌药物情况下的检出率与目前常用的另一血培养系统BD BACTECTM FX的比较,目前相关报道较少,本研究将对二者的检出性能进行比较分析。
1 材料与方法 1.1 材料抗菌药物亚胺培南、美罗培南、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦、青霉素G、万古霉素、达托霉素、甲硝唑、氟康唑和米卡芬净均购自大连美仑生物技术有限公司。大肠埃希菌ATCC 25922、肺炎克雷伯菌ATCC 700603、鲍曼不动杆菌ATCC 19606、金黄色葡萄球菌ATCC 29213、肺炎链球菌ATCC 49617、脆弱拟杆菌ATCC 25285和白念珠菌ATCC 14053均购自国家卫生健康委员会临床检验中心,光滑念珠菌为临床分离株。
1.2 培养方法除白念珠菌和光滑念珠菌接种在沙氏培养基(SDA)外,其余菌株均接种于哥伦比亚血琼脂平板(BA),35℃孵箱培养,肺炎链球菌另外需要5% CO2气体环境,而脆弱拟杆菌放在厌氧袋(Oxid,英国)中培养。细菌药敏情况由梅里埃VITEK Compact 2系统测定,真菌药敏情况由天地人公司的酵母样板测定。血培养瓶为梅里埃公司的FA+需氧瓶和FN+厌氧瓶,用于梅里埃公司的BACT/ALERT VIRTUO血培养系统;BD公司的含树脂需氧培养瓶(Plus aerobic/F culture vials, AF)和含溶血素厌氧培养瓶(Lytic/10 anaerobic/F culture vials, ANF),用于BD公司的BACTECTM FX血培养系统。
1.2.1 模拟血培养从新鲜培养基上刮取数个单个菌落,用无菌生理盐水调成0.5麦氏单位,再用生理盐水稀释成100 CFU/mL的菌液。在血培养瓶中预先加入9 mL的马血(购自北京奥科赛德生物技术有限公司,用于肺炎链球菌和脆弱拟杆菌)或无菌PBS(pH 7.2)缓冲液(其他菌)。将配好模拟血药浓度的抗菌药物0.3 mL和稀释好的0.3 mL菌液即约30 CFU/瓶,为美国临床实验室标准化协会(CLSI)规定的血培养瓶的检测期限加入血培养瓶中,生长对照瓶用等量的无菌生理盐水代替抗菌药物。抗菌药物所用浓度根据文献[9-10]报道的最高血药浓度进行设计并微调,见表 1。大肠埃希菌对美罗培南的最低抑菌浓度(minimum inhibitory concentration, MIC)值非常低,肺炎克雷伯菌所用美罗培南浓度根据大肠埃希菌来定。试验组每组为5瓶进行3次重复试验,对照组则每组3瓶重复。混匀后在30 min内将血培养瓶放入相应的血培养系统进行生长检测,培养至5 d(120 h)时仍未报阳则判定为无菌生长。同时每种稀释好的菌液取0.3 mL于BA(细菌)或SDA(真菌)中培养24~48 h,验证试验用的菌落数。
| 表 1 临床治疗中抗菌药物的血药峰浓度和本研究中使用的抗菌药物测试浓度 Table 1 Peak blood concentration of antimicrobial agents in clinical therapy and test concentration of antimicrobial agents in this study |
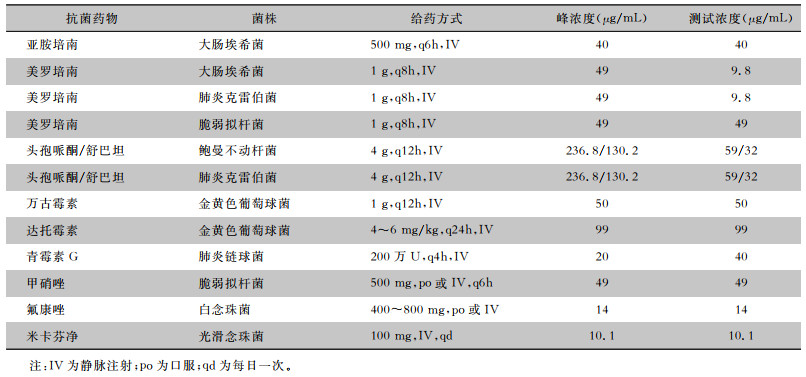
|
以美罗培南、万古霉素和氟康唑为代表。在血培养瓶中分别注入模拟血浆峰浓度的美罗培南(49 μg/mL)、万古霉素(50 μg/mL)和氟康唑(14 μg/mL)后,0、2、10 min后分别抽取1 mL培养瓶中液体检测氟康唑的浓度;万古霉素和美罗培南检测需氧瓶中0、2、10 min和4 h后的浓度。试验重复2次。药物浓度采用岛津快速色谱仪进行检测。
1.2.3 统计学分析应用GraphPad Prism 8.0.1软件进行统计,检出率的比较采用卡方检验;报阳时间的比较采用t检验。P≤0.05为差异有统计学意义。
2 结果 2.1 菌株体外药敏结果本研究所用的试验菌株对相应抗菌药物的MIC值见表 2。所用菌株对测试抗菌药物均敏感。
| 表 2 试验菌株对抗菌药物的MIC值和药敏判断结果 Table 2 MIC values and antimicrobial susceptibility results of tested strains |
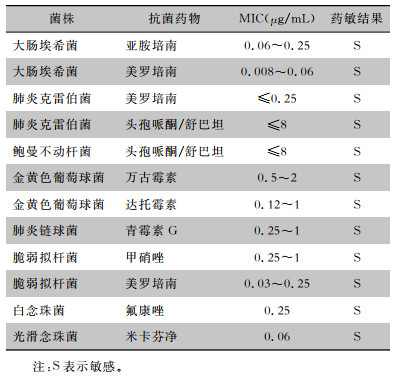
|
将与注入血培养瓶中等量的菌液涂布于BA或SDA上培养计数菌落数,结果见图 1,菌落数范围为7~30 CFU,检测敏感度符合CLSI的要求。
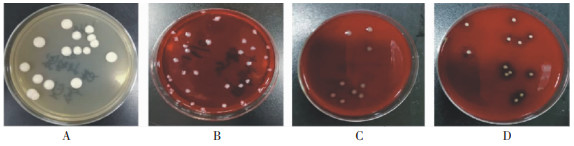 |
| 注:A.白念珠菌,沙氏培养基,28℃,48 h;B.脆弱拟杆菌,血琼脂,35℃,48 h;C.大肠埃希菌,血琼脂,35℃,24 h;D.金黄色葡萄球菌,血琼脂,35℃,24 h。 图 1 试验菌液在平皿上生长情况 Figure 1 Growth of tested bacterial solution on sheep blood plates |
所有菌株在生长对照瓶里均在检测期限内报阳,表明该试验系统可靠有效。在所有含抗菌药物的培养瓶里,FX系统的厌氧瓶均无菌株生长。大肠埃希菌和肺炎克雷伯菌在亚胺培南、美罗培南存在的情况下,FX系统的两种培养瓶、VIRTUO系统的需氧瓶不能检出,但VIRTUO的厌氧瓶可以100%检出。鲍曼不动杆菌在所有培养瓶中均不能生长。脆弱拟杆菌在甲硝唑和美罗培南存在时,在FN+厌氧瓶中可以100%检出,而FX的ANF厌氧瓶均不能检出。米卡芬净对光滑念珠菌的检出影响显著,在VIRTUO的FA+需氧瓶中可以100%检出,但是FX需氧瓶AF检出率为0。总体而言,在抗菌药物存在的情况下,菌株在VIRTUO的FA+需氧瓶、FN+厌氧瓶和FX的AF需氧瓶、ANF厌氧瓶中的检出率分别是60.00%、84.00%、40.00%和0,FN+厌氧瓶的检出率高于FA+需氧瓶,差异有统计学意义(P=0.008);FA+需氧瓶的检出率高于AF需氧瓶,差异有统计学意义(P=0.046)。见表 3。
| 表 3 试验菌株暴露于抗菌药物培养时血培养瓶的报阳情况[阳性瓶数/总瓶数(%)] Table 3 Positive report of blood culture vials when the tested strains are exposed to antimicrobial agents during culture (No. of positive vials/total No. of vials [%]) |
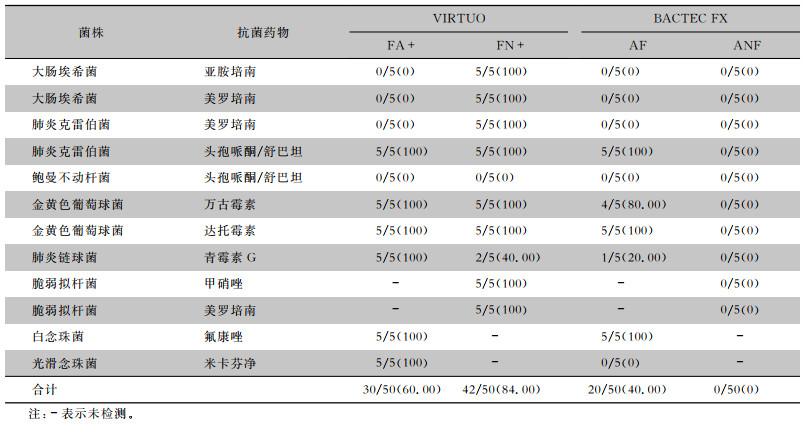
|
在无抗菌药物的情况下,VIRTUO FA+需氧瓶对大肠埃希菌、肺炎克雷伯菌、金黄色葡萄球菌、白念珠菌的TTP时间均短于FX的AF需氧瓶,差异均有统计学意义(均P<0.05);厌氧瓶TTP之间的比较,FX ANF厌氧瓶对金黄色葡萄球菌和脆弱拟杆菌的TTP时间早于VIRTUO FN+厌氧瓶,差异均有统计学意义(均P<0.05);在同一种培养系统,除了检测金黄色葡萄球菌在需氧瓶和厌氧瓶的TTP时间比较,差异有统计学意义之外(均P<0.05),其余均无统计学差异。
在有抗菌药物存在的情况下,VIRTUO FA+需氧瓶对肺炎克雷伯菌(头孢哌酮/舒巴坦)、金黄色葡萄球菌、白念珠菌的TTP时间均短于FX的AF需氧瓶,差异均有统计学意义(均P<0.05);同一系统内,VIRTUO FA+需氧瓶对肺炎克雷伯菌(头孢哌酮/舒巴坦)、金黄色葡萄球菌的TTP时间均短于FN+厌氧瓶,差异有统计学意义(均P<0.05)。抗菌药物的存在使TTP时间延长。见表 4。
| 表 4 试验菌株在有(试验)/无(对照)抗菌药物培养时血培养瓶的平均报阳时间(h) Table 4 The mean positive reporting time of blood culture vials with (test)/without (control) antimicrobial agents (Hour) |

|
将本研究模拟血培养所用相应浓度的氟康唑、美罗培南和万古霉素注入血培养瓶中,经过一定的时间检测培养瓶中抗菌药物浓度变化,见图 2。FX的厌氧培养瓶ANF因为无吸附剂,除了抗菌药物本身的降解外,抗菌药物的浓度基本没有影响。FA+需氧瓶、FN+厌氧瓶和AF需氧瓶均对抗菌药物有吸附作用,以FN+厌氧瓶对美罗培南的吸附作用最为明显,2 min时浓度即降低了约90%,在10 min时美罗培南的浓度仅有原来的8.56%。FA+需氧瓶和AF需氧瓶对氟康唑的吸附效果相近,分别为72.7%和68.1%。在所测的三个时间段,FA+需氧瓶和FN+厌氧瓶中万古霉素的残余浓度均低于AF需氧瓶和ANF厌氧瓶,见图 2。
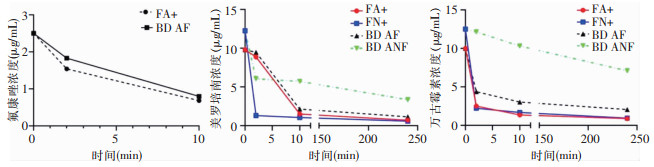 |
| 图 2 色谱法检测氟康唑、美罗培南和万古霉素不同时间在FA+、FN+、AF和AFN培养瓶中的浓度 Figure 2 Concentrations of fluconazole, meropenem and vancomycin in FA+, FN+, AF and AFN blood culture vials at different time tested by chromatography |
大肠埃希菌、肺炎克雷伯菌、鲍曼不动杆菌、金黄色葡萄球菌是全国细菌耐药监测网(China Antimicrobial Resistance Surveillance System, CARSS)报道的血培养中经常分离的几种细菌[11],肺炎链球菌是社区获得性肺炎患者血培养时最常分离的细菌[12],脆弱拟杆菌是血流感染中最常分离的厌氧菌[13],白念珠菌是血培养最常检出的真菌,光滑念珠菌在近年的血培养中其检出率则不断上升[14]。有效快速地检测出血流感染的病原菌及进行准确的鉴定和药敏试验,对于指导临床医生优化治疗方案,提高患者的生存率有重要意义[15]。
目前常用的血培养检测系统为BD公司的BACTECTM FX和梅里埃公司的BACT/ALERT 3D(BTA3D)。FX系统2011年在中国上市,在BD公司的各种血培养瓶单独或组合里,树脂培养瓶和含溶血素厌氧瓶的组合对于微生物检出率最高和检出时间最短[16]。BACT/ALERT VIRTUO是梅里埃公司最新一代血培养检测系统,2017年在中国上市,利用比色检测原理,配合使用含聚合物小珠的FA+需氧培养瓶和FN+厌氧培养瓶,采用比BACT/ALERT 3D系统更优的设计提升其性能[17]。
本研究显示,在抗菌药物存在的情况下,VIRTUO系统和FX系统在阳性检出率上有显著优势,VIRTUO系统内部的FA+需氧瓶和FN+厌氧瓶的阳性检出率之间也有统计学差异,阳性检出率为:VIRTUO FN+厌氧瓶>FA+需氧瓶>FX AF需氧瓶>ANF厌氧瓶。阳性检出率的差异在有碳青霉烯类抗生素(亚胺培南和美罗培南)存在时尤其明显。对于大肠埃希菌和肺炎克雷伯菌,在碳青霉烯类抗生素存在时,仅VIRTUO FN+厌氧瓶可检测出,其他组别检出率均为0。这与FN+厌氧瓶更强的抗菌药物灭活能力有关[18],可能FN+厌氧瓶中的多聚吸附珠在厌氧环境中可以更好的发挥吸附作用,从而可以有效降低碳青霉烯类抗生素的影响。Menchinelli等[19]报道VIRTUO FN+厌氧瓶在美罗培南浓度为50 μg/mL时所测肺炎克雷伯菌均可报阳。
在TTP时间方面,总体而言,在无抗菌药物存在的情况下,VIRTUO系统的FA+需氧瓶检出时间(中位数12.24 h)总体上要短于FX系统的需氧瓶AF(中位数14.1 h),而FX系统的ANF厌氧瓶检出时间(中位数13.78 h)则短于VIRTUO系统FN+(中位数15.07 h)。之前也有报道BD的溶血素厌氧瓶报阳时间要短于BACT/ALERT FN+瓶[20]。但是,在有抗菌药物存在的情况下,VIRTUO的TTP中位数时间则显著短于FX系统,这个结论与文献[21]报道的相似。在最近的一项采用健康人血标本进行的模拟血培养,结果也表明VIRTUO与其先一代产品BTA3D以及BD FX相比,对于大多数测试的微生物均可以更快的检测到其生长,表明其具有更大的潜力,可以改善实验室对菌血症和真菌病的检测[22]。
对抗菌药物浓度的检测结果进一步说明VIRTUO系统FN+厌氧瓶对美罗培南独具优势的吸附效果。2 min时FN+厌氧瓶对美罗培南的吸附即接近90%,10 min时仅残余原来的8.56%。VIRTUO系统FN+厌氧瓶在有无美罗培南存在的情况下TTP相差时间≤3 h也验证了FN+厌氧瓶对美罗培南的吸附效果。总体而言,VIRTUO系统对所测抗菌药物的吸附要优于FX系统。
抗菌药物的存在则使每一种培养瓶的报阳时间均延长,并且导致鲍曼不动杆菌在两种血培养系统中均无法检出,这些结果提示临床需要尽量在抗菌药物使用之前采集血标本进行培养,即使不能做到这一点,也尽量在抗菌药物谷底浓度时采样,最大限度减少抗菌药物对血培养的干扰。
本研究的局限性在于采用的是模拟血培养,培养液部分用PBS或马血代替了人血,与临床患者血标本还是存在差别。最佳的选择应是将同一例患者的血标本分别注入两个系统进行培养,并且进行大样本量的比对。另外,本研究所用的菌株基本上都是标准菌株,缺少临床菌株,所测的抗菌药物种类也有限。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Rudd KE, Johnson SC, Agesa KM, et al. Global, regional, and national sepsis incidence and mortality, 1990-2017:analysis for the global burden of disease study[J]. Lancet, 2020, 395(10219): 200-211. DOI:10.1016/S0140-6736(19)32989-7 |
| [2] |
Xie JF, Wang HL, Kang Y, et al. The epidemiology of sepsis in Chinese ICUs: a national cross-sectional survey[J]. Crit Care Med, 2020, 48(3): e209-e218. DOI:10.1097/CCM.0000000000004155 |
| [3] |
Reinhart K, Daniels R, Kissoon N, et al. Recognizing sepsis as a global health priority-a WHO resolution[J]. N Engl J Med, 2017, 377(5): 414-417. DOI:10.1056/NEJMp1707170 |
| [4] |
Kennedy JN, Rudd KE. A sepsis early warning system is associated with improved patient outcomes[J]. Cell Rep Med, 2022, 3(9): 100746. DOI:10.1016/j.xcrm.2022.100746 |
| [5] |
Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021[J]. Crit Care Med, 2021, 49(11): e1063-e1143. DOI:10.1097/CCM.0000000000005337 |
| [6] |
Opota O, Croxatto A, Prod'hom G, et al. Blood culture-based diagnosis of bacteraemia: state of the art[J]. Clin Microbiol Infect, 2015, 21(4): 313-322. DOI:10.1016/j.cmi.2015.01.003 |
| [7] |
Li LQ, Xu LC, Zhu RS, et al. Effect of prior receipt of antibio-tics on the pathogen distribution: a retrospective observational cohort study on 27, 792 patients[J]. BMC Infect Dis, 2020, 20(1): 8. DOI:10.1186/s12879-019-4724-6 |
| [8] |
Gonzalez MD, Chao T, Pettengill MA. Modern blood culture: management decisions and method options[J]. Clin Lab Med, 2020, 40(4): 379-392. DOI:10.1016/j.cll.2020.07.001 |
| [9] |
Clinical and Laboratory Standards Institute. M100: perfor-mance standards for antimicrobial susceptibility testing: 30th edition[EB/OL]. [2022-11-01]. https://clsi.org/media/3481/m100ed30_sample.pdf.
|
| [10] |
Gilbert DN, Chambers HF, Eliopoulos GM, et al. The Sanford guide to antimicrobial therapy 2018[M]. 48th ed. Virgi-nia: Antimicrobial Therapy, 2018.
|
| [11] |
全国细菌耐药监测网. 全国细菌耐药监测网2014-2019年血标本病原菌耐药性变迁[J]. 中国感染控制杂志, 2021, 20(2): 124-133. China Antimicrobial Resistance Surveillance System. Change in antimicrobial resistance of pathogens from blood specimens: surveillance report from China Antimicrobial Resistance Surveillance System in 2014-2019[J]. Chinese Journal of Infection Control, 2021, 20(2): 124-133. |
| [12] |
Haessler S, Guo N, Deshpande A, et al. Etiology, treatments, and outcomes of patients with severe community-acquired pneumonia in a large U.S. sample[J]. Crit Care Med, 2022, 50(7): 1063-1071. DOI:10.1097/CCM.0000000000005498 |
| [13] |
Zouggari Y, Lelubre C, Lali SE, et al. Epidemiology and outcome of anaerobic bacteremia in a tertiary hospital[J]. Eur J Intern Med, 2022, 105: 63-68. DOI:10.1016/j.ejim.2022.08.024 |
| [14] |
Israel S, Amit S, Israel A, et al. The epidemiology and susceptibility of candidemia in Jerusalem, Israel[J]. Front Cell Infect Microbiol, 2019, 9: 352. DOI:10.3389/fcimb.2019.00352 |
| [15] |
Pant A, Mackraj I, Govender T. Advances in sepsis diagnosis and management: a paradigm shift towards nanotechnology[J]. J Biomed Sci, 2021, 28(1): 6. DOI:10.1186/s12929-020-00702-6 |
| [16] |
Rocchetti A, Di Matteo L, Bottino P, et al. Prospective study of the clinical performance of three BACTEC media in a mo-dern emergency department: Plus aerobic/F, Plus anaerobic/F, and anaerobic lytic/F[J]. J Microbiol Methods, 2016, 130: 129-132. DOI:10.1016/j.mimet.2016.09.008 |
| [17] |
Adamik M, Hutchins A, Mangilit J, et al. Effect of delayed entry on performance of the BACT/ALERT FAN PLUS bo-ttles in the BACT/ALERT VIRTUO blood culture system[J]. Eur J Clin Microbiol Infect Dis, 2021, 40(4): 699-705. DOI:10.1007/s10096-020-04042-z |
| [18] |
Xu XY, Wei Q, Wang Z, et al. Inactivation of clinically frequently used antimicrobial agents by BacT/ALERT FAN plus and BACTEC aerobic and anaerobic culture media in simulated blood cultures: first comparative evaluation in China mainland[J]. Infect Drug Resist, 2021, 14: 163-172. DOI:10.2147/IDR.S290222 |
| [19] |
Menchinelli G, Liotti FM, Giordano L, et al. Efficient inactivation of clinically relevant antimicrobial drug concentrations by BacT/alert or bactec resin-containing media in simulated adult blood cultures[J]. Antimicrob Agents Chemother, 2019, 63(7): e00420-19. |
| [20] |
Almuhayawi M, Altun O, Abdulmajeed AD, et al. The performance of the four anaerobic blood culture bottles BacT/ALERT-FN, -FN plus, BACTEC-plus and -lytic in detection of anaerobic bacteria and identification by direct MALDI-TOF MS[J]. PLoS One, 2015, 10(11): e0142398. DOI:10.1371/journal.pone.0142398 |
| [21] |
Chung Y, Kim IH, Han M, et al. A comparative evaluation of BACT/ALERT FA PLUS and FN PLUS blood culture bottles and BD BACTEC plus aerobic and anaerobic blood culture bottles for antimicrobial neutralization[J]. Eur J Clin Microbiol Infect Dis, 2019, 38(12): 2229-2233. DOI:10.1007/s10096-019-03663-3 |
| [22] |
Menchinelli G, Liotti FM, Fiori B, et al. In vitro evaluation of BACT/ALERT® VIRTUO®, BACT/ALERT 3D®, and BACTECTM FX automated blood culture systems for detection of microbial pathogens using simulated human blood samples[J]. Front Microbiol, 2019, 10: 221. DOI:10.3389/fmicb.2019.00221 |



