人型支原体是一类没有细胞壁,具有多形性,可通过滤菌器的已知最小原核型微生物。在人体中,其主要引起泌尿生殖系统感染,而在中枢神经系统中引起的感染较为少见。其引起的颅内感染主要见于新生儿,常源于母体生殖系统感染或携带而获得[1],而成人颅内感染的病例报道则极为少见,且引起的颅内感染在诊断、治疗、预后管理等方面尚缺乏统一的共识。现对2021年某院临床工作中1例经基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)技术确诊的成人人型支原体颅内感染病例的诊疗过程进行报告,以期为临床此类疾病的诊治提供参考。
1 临床资料患者男性,52岁,于2021年11月22日凌晨4点左右,在驾驶小货车的途中与小轿车相撞,伤后即昏迷,随即被120救护车送往当地医院救治。头部CT提示脑挫裂伤及弥漫性轴索损伤,给予脱水降颅压、伤口清创缝合、气管插管呼吸机辅助呼吸等救治措施。当日上午10点,患者头部CT复查提示脑内挫裂伤加重,遂因“车祸伤后意识障碍12 h”送至我院神经外科重症监护病房(ICU)。患者10年前行阑尾切除术,术后恢复良好。入院查体:意识深昏迷,右顶部头皮裂伤约3 cm,已行清创缝合,刺痛无睁眼,气管插管状态,痛刺激右上肢伸直反应,格拉斯哥昏迷量表(GCS)5分;双瞳等大等圆2 mm,光反射迟钝,右耳廓上半部缺如,耳鼻无溢液,右侧锁骨远端可扪及骨擦感;双肺听诊呼吸音粗,可闻及广泛干湿啰音,肌力未检查。入院头部CT提示:广泛脑挫裂伤伴脑内血肿、弥漫性轴索损伤及蛛网膜下腔出血伴脑室积血;胸部CT提示:肺挫裂伤伴肺部感染。结合临床表现、查体及辅助检查,初步诊断为:(1)重型闭合性颅脑损伤(广泛脑挫裂伤伴脑内血肿形成;弥漫性轴索损伤;外伤性蛛网膜下腔出血伴脑室积血;右顶部头皮裂伤;右耳廓撕裂缺失伤);(2)右侧锁骨、颈7椎体右侧横突骨折;(3)肺挫裂伤伴肺部感染;(4)气管插管术后。11月23日急诊行“双侧颅骨切除减压术+脑膜切开术+脑脊液漏修补术”及“颅内压探头置入术”,术后给予重症监护,并给予哌拉西林/舒巴坦(5.0 g q8h,静脉滴注)行肺部经验性抗感染治疗。之后患者痰培养多次检出多重耐药铜绿假单胞菌,治疗以针对肺部感染及对症处置为主,11月28日—12月5日哌拉西林/舒巴坦(5.0 g,q6h)+左氧氟沙星(0.5 g,qd)静脉滴注,12月6日哌拉西林/舒巴坦(5.0 g,q6h)+阿米卡星(0.8 g,qd)静脉滴注,阿米卡星(0.2 g,q8h)雾化吸入;12月7—8日头孢哌酮/舒巴坦(2.0 g,q8h)+阿米卡星(0.8 g,qd)静脉滴注,阿米卡星(0.2 g,q8h)雾化吸入,此期间患者病情无明显变化。12月5日患者开始出现不同程度的间断发热,最高温度达39.8℃,多次腰椎穿刺出黄色、淡红色或黄褐色、浑浊、伴或不伴有絮状沉淀的异常脑脊液。12月9日送检脑脊液镜下可见大量有核细胞(以多个核为主),氯112.4 mmol/L、葡萄糖1.65 mmol/L、乳酸脱氢酶329.6 IU/L、脑脊液总蛋白2.03 g/L,提示颅内感染的可能,遂于当日加用万古霉素(1 000 mg,q12h,静脉滴注)抗颅内感染治疗。12月13日患者腰大池置管后持续引流出异常脑脊液,手术切口多处存在痂下化脓,拆除干痂后部分切口有裂开并有脓液溢出,给予拆除缝线并清创。至12月16日,患者仍有反复高热,引流管引流出少许白色絮状沉积物,抗菌药物调整为利奈唑胺(0.6 g,q12h)+美罗培南(1.0 g,q6h)+阿米卡星(0.8 g,qd)静脉滴注联合治疗。至12月24日,患者脑脊液指标逐渐好转,但仍有间断发热,同时伴有脑耗盐综合征,手术切口缝合处仍有少许脓液流出,拔除的纱条上粘有部分坏死组织,遂将抗菌药物调整为利奈唑胺(0.6 g,q12h,胃管注入)和哌拉西林/舒巴坦(5.0 g,q6h,静脉滴注)联合治疗。12月27日患者脑脊液及手术切口分泌物培养出人型支原体,故加用米诺环素(100 mg,bid,胃管注入)及切口外用红霉素软膏针对人型支原体感染。至2022年1月19日,患者颅内感染得到有效控制,手术切口愈合逐渐好转,体温趋于正常,于2月15日转至普通病房,后续治疗以针对肺部感染及对症处置为主。2022年3月5日患者生命体征平稳,体温正常,应家属要求,回当地医院继续治疗。
2 培养及鉴定2021年12月15日送检的手术切口分泌物及12月16日送检的脑脊液经CO2条件培养72 h后,在含5%的羊血琼脂平板上可见中等数量生长的无色透明、针尖样大小的菌落,见图 1,革兰染色未见单个菌体形态,瑞氏吉姆萨染色可见紫红色的细小球形菌体,见图 2。12月23日送检的脑脊液再次培养出相同菌落。该菌经MALDI-TOF-MS质谱分析技术鉴定为人型支原体,而16s rRNA技术多次未识别成功。为争取患者救治时间,采用米诺环素(100 mg,bid,口服)及红霉素软膏外用的治疗方案治疗人型支原体颅内感染。同时为进一步验证质谱分析结果的准确性,将该菌接种于人型支原体的选择分离培养基(A7固体培养基),经CO2条件培养后,低倍镜下可见人型支原体典型的中央厚、边缘薄的“油煎蛋”样菌落形态,见图 3。因此,结合分离培养基上典型的菌落形态及特有的镜下形态可进一步佐证质谱分析结果的准确性。同时液体培养药敏结果显示,对强力霉素、米诺环素、交沙霉素及壮观霉素敏感,对阿奇霉素、克拉霉素、诺氟沙星、环丙沙星、罗红霉素、司帕沙星、氧氟沙星及左氧氟沙星耐药。该患者采用米诺环素联合红霉素软膏的方案治疗后,2022年1月19日脑脊液常规:无色水样、清晰透明、无凝块,有核细胞计数23×106/L(单个核占80%,多个核占20%),红细胞计数2.0×106/L,潘氏试验弱阳性;脑脊液生化:氯114.4 mmol/L、葡萄糖6.44 mmol/L、乳酸脱氢酶14.8 IU/L、脑脊液总蛋白0.48 g/L;脑脊液培养阴性;手术切口恢复良好。在上述方案治疗25 d后,患者颅内感染得到有效控制。
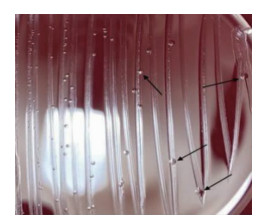 |
| 图 1 人型支原体在5%羊血琼脂平板上生长3 d后的菌落形态(箭头所示) Figure 1 Colony morphology of Mycoplasma hominis after growing on 5% sheep blood agar plate for 3 days |
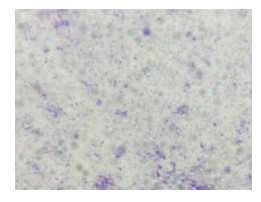 |
| 图 2 人型支原体瑞氏吉姆萨染色(1 000×) Figure 2 Wright's-Giemsa staining of Mycoplasma hominis (1 000×) |
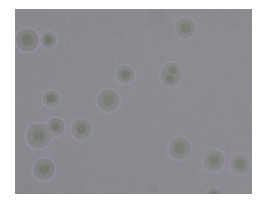 |
| 图 3 人型支原体在A7固体培养基上生长2 d后的镜下形态(50×) Figure 3 Microscopic morphology of Mycoplasma hominis after growing on A7 solid medium for 2 days (50×) |
人型支原体缺乏细胞壁,结构简单,生物合成能力有限,常于咽部和呼吸道及部分女性的泌尿生殖道定植[2-3],呈腐生或寄生状态。其很少穿透黏膜下层,通常在免疫抑制或器械入侵操作时入血播散[4]。免疫抑制、恶性肿瘤、创伤、泌尿生殖道操作或手术等被认为是人型支原体生殖器外感染的易感因素[5-8]。人型支原体引起的颅内感染通常考虑创伤期间的直接污染、手术期间的直接污染或因泌尿生殖系统操作导致菌血症而继发的颅内感染三种途径[9-11]。而在目前的有关成人人型支原体颅内感染的病例报道中,普遍存在头部外伤、神经外科手术或泌尿生殖系统侵入性操作史[4-6, 8-9, 12-15]。因此,流行病学常无法具体确定是由哪一种途径导致的感染。有观点认为,迟发性颅内手术部位感染可能来自医源性尿路创伤的播散,而早期出现的感染是在头部创伤时直接接种[8, 10]。本例患者有头部外伤、神经外科手术、气管插管及全程留置导尿管,术后12 d开始出现颅内感染症状,血培养未检出病原菌(真阴性,或假阴性:如血培养瓶中的聚茴香脑磺酸钠有可能对人型支原体的生长存在抑制作用),因此流行病学无法辨别引起颅内感染的确切因素。但结合患者感染症状出现的时间及手术切口的临床表现来推测,本文认为该患者的感染因素更倾向于外科手术切口污染所导致的颅内感染。
虽然人型支原体可在常规培养条件下生长,但因其生长缓慢、菌落小且常规染色(如革兰染色等)不易识别等因素,导致其在临床工作中极易被漏检。加之人型支原体引起的成人颅内感染极为少见且缺乏特异的临床表现,所以相较于其他常见菌引起的颅内感染,临床对其认识尚存在不足。此类菌难培养、难识别、难鉴定及颅内感染的常规经验性用药(如β-内酰胺类、糖肽类等)对其难覆盖等因素,导致人型支原体引起颅内感染的确诊周期普遍延迟。因此,由人型支原体颅内感染导致的高病死率被认为是延迟诊断和无效初始治疗的结果[1],并由此多导致神经系统后遗症[16]。该病例从出现颅内感染到开始针对人型支原体治疗的周期为22 d,其中从第一次送检脑脊液培养到检出人型支原体生长的周期为16 d,而得到人型支原体固体培养法确认及药敏结果的周期却为30 d。可见,实验室在缩短临床实施针对性治疗的起始时间上起着关键作用。此外,当存在颅内感染指征而多次未培养出病原菌时,临床医生应高度重视此类特殊病原菌感染的可能,特别是在脓性标本中存在大量分叶核而未见菌体的情况下,可要求实验室延长培养时间(一般3~5 d)。
MALDI-TOF-MS技术是目前应用于临床微生物学菌种鉴定的常规手段,相较于传统培养,其不仅操作简单、价格低廉,能鉴定一些常规细菌鉴定仪不能鉴定的菌种外,还可大大缩短微生物培养的报告时间。但MALDI-TOF-MS技术对于人型支原体鉴定的可行性,目前尚存在一些争议[7-9, 14-16],可能主要源于比对库信息的完善程度,因此对于此类特殊病原菌的鉴别,该技术尚在探索和完善中。本例人型支原体由MALDI-TOF-MS技术快速鉴定出,并得到金标准固体培养法的证实,而16s rRNA测序方法未能识别出本株菌种(此情况较为少见)。由此可见,虽然16s rRNA测序的方法在目前菌种鉴定中比较受推崇,但在其能力受限时,MALDI-TOF-MS技术不失为一种互补手段,两者可相互印证,互为补充。
由于人型支原体结构特殊(如无细胞壁且不能合成叶酸),其对所有β-内酰胺类、磺胺类、甲氧苄啶、利福平及所有其他作用于细胞壁结构的药物均具有耐药性[17],但对林可酰胺类、四环素类、氟喹诺酮类和氯霉素则具有较好的敏感性[18]。由于氯霉素可能导致再生障碍性贫血,而克林霉素的血-脑屏障渗透性差,因此四环素类和氟喹诺酮类已成为治疗人型支原体颅内感染的一线药物,特别是多西环素和莫西沙星的治疗效果在以往的病例报道中已得到证实。而当出现多重耐药的人型支原体感染时,克林霉素、交沙霉素和替加环素可作为替代疗法[19]。此外,在人型支原体颅内感染的治疗中,引流和清创同样起着非常重要的作用。
综上所述,由于人型支原体引起的成人颅内感染极为少见,且在临床感染中不易被检出,故临床工作者不仅要加强对此类疾病的认识,同时也应提高对此类病原菌鉴定手段的了解,以期提升此类疾病的诊断率和治愈率。此外,人型支原体颅内感染的预后尚缺乏大数据的研究,本例患者转院后也未能了解到其预后情况,这也成为此文的不足之处。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Hata A, Honda Y, Asada K, et al. Mycoplasma hominis meningitis in a neonate: case report and review[J]. J Infect, 2008, 57(4): 338-343. DOI:10.1016/j.jinf.2008.08.002 |
| [2] |
Chua KB, Ngeow YF, Ng KB, et al. Ureaplasma urealyti-cum and Mycoplasma hominis isolation from cervical secretions of pregnant women and nasopharyngeal secretions of their babies at delivery[J]. Singapore Med J, 1998, 39(7): 300-302. |
| [3] |
McCarthy KL, Looke DFM. Successful treatment of post-neurosurgical intracranial Mycoplasma hominis infection using gatifloxacin[J]. J Infect, 2008, 57(4): 344-346. DOI:10.1016/j.jinf.2008.06.022 |
| [4] |
Qamar Z, Tjoumakaris S, Pettengill MA, et al. Intracranial Mycoplasma hominis infection following emergent craniectomy[J]. IDCases, 2021, 25: e01175. DOI:10.1016/j.idcr.2021.e01175 |
| [5] |
Zheng X, Olson DA, Tully JG, et al. Isolation of Mycoplasma hominis from a brain abscess[J]. J Clin Microbiol, 1997, 35(4): 992-994. DOI:10.1128/jcm.35.4.992-994.1997 |
| [6] |
Al Masalma M, Drancourt M, Dufour H, et al. Mycoplasma hominis brain abscess following uterus curettage: a case report[J]. J Med Case Rep, 2011, 5: 278. DOI:10.1186/1752-1947-5-278 |
| [7] |
Stabler S, Faure E, Duployez C, et al. The brief case: Mycoplasma hominis extragenital abscess[J]. J Clin Microbiol, 2021, 59(4): e02343-20. |
| [8] |
Henao-Martínez AF, Young H, Nardi-Korver JJL, et al. Mycoplasma hominis brain abscess presenting after a head trauma: a case report[J]. J Med Case Rep, 2012, 6: 253. DOI:10.1186/1752-1947-6-253 |
| [9] |
Zhou ML, Wang P, Chen S, et al. Meningitis in a Chinese adult patient caused by Mycoplasma hominis: a rare infection and literature review[J]. BMC Infect Dis, 2016, 16(1): 557. DOI:10.1186/s12879-016-1885-4 |
| [10] |
Kupila L, Rantakokko-Jalava K, Jalava J, et al. Brain abscess caused by Mycoplasma hominis: a clinically recognizable entity?[J]. Eur J Neurol, 2006, 13(5): 550-551. DOI:10.1111/j.1468-1331.2006.01209.x |
| [11] |
Pailhoriès H, Rabier V, Eveillard M, et al. A case report of Mycoplasma hominis brain abscess identified by MALDI-TOF mass spectrometry[J]. Int J Infect Dis, 2014, 29: 166-168. DOI:10.1016/j.ijid.2014.08.004 |
| [12] |
Cohen M, Kubak B. Mycoplasma hominis meningitis complicating head trauma: case report and review[J]. Clin Infect Dis, 1997, 24(2): 272-273. DOI:10.1093/clinids/24.2.272 |
| [13] |
Diab A, AlMusawi SSM, Hudhaiah D, et al. Iatrogenic ventriculitis due to Mycoplasma hominis: a case report and review of the literature[J]. Am J Case Rep, 2019, 20: 406-411. DOI:10.12659/AJCR.914284 |
| [14] |
Bergin SM, Mendis SM, Young B, et al. Postoperative Mycoplasma hominis brain abscess: keep it in mind![J]. BMJ Case Rep, 2017, 2017: bcr2016218022. |
| [15] |
Potruch A, Rosenthal G, Michael-Gayego A, et al. A case report of Mycoplasma hominis subdural empyema following decompressive craniotomy, and a review of central nervous system Mycoplasma hominis infections[J]. Front Med (Lausanne), 2022, 9: 792323. |
| [16] |
Scaggs Huang FA, Mortensen J, Skoch J, et al. Successful whole genome sequencing-guided treatment of Mycoplasma hominis ventriculitis in a preterm infant[J]. Pediatr Infect Dis J, 2019, 38(7): 749-751. DOI:10.1097/INF.0000000000002306 |
| [17] |
Ahmed J, Rawre J, Dhawan N, et al. Mycoplasma hominis: an under recognized pathogen[J]. Indian J Med Microbiol, 2021, 39(1): 88-97. DOI:10.1016/j.ijmmb.2020.10.020 |
| [18] |
Yeung T, Chung E, Chen J, et al. Therapeutic drug monitoring of moxifloxacin to guide treatment of Mycoplasma hominis meningitis in an extremely preterm infant[J]. J Pediatr Pharmacol Ther, 2021, 26(8): 857-862. |
| [19] |
Chalker VJ, Sharratt MG, Rees CL, et al. Tetracycline resistance mediated by tet(M) has variable integrative conjugative element composition in Mycoplasma hominis strains isolated in the United Kingdom from 2005 to 2015[J]. Antimicrob Agents Chemother, 2021, 65(4): e02513-20. |



