2. 中国医学科学院感染病及微生态研究创新单元, 浙江 杭州 310003;
3. 浙江大学医学院第一附属医院肝胆胰外科, 浙江 杭州 310003
2. Research Units of Infectious disease and Microecology, Chinese Academy of Medical Sciences, Hangzhou 310003, China;
3. Department of Hepatobiliary and Pancreatic Surgery, The First Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310003, China
链球菌是一大组革兰阳性球菌,广泛分布在自然界,作为机会性致病菌常定植于人体咽部、呼吸道、胃肠道和泌尿生殖道[1-2],可引起咽炎和脓疱病等浅表性感染,以及坏死性筋膜炎、血流感染、脑膜炎、肺炎、骨髓炎或关节炎等侵袭性感染,其中化脓性链球菌还会导致急性肾小球肾炎、风湿性心脏病等免疫相关并发症。据统计,化脓性链球菌感染每年造成全球50多万人死亡[3]。无乳链球菌侵袭性感染则在糖尿病、肿瘤患者中的发病率明显升高[4],咽峡炎链球菌也从黏膜共生菌逐渐成为可形成各类脓肿的致病菌[5]。
链球菌血流感染是链球菌侵袭性感染中常见且严重的疾病[6-7],而链球菌是引起血流感染的前10位细菌病原体之一[8-9]。比利时、美国等的研究[7-10]指出,链球菌侵袭性感染在老年人和具有基础疾病患者中的发病率逐渐升高,特别是实体肿瘤、高血压、糖尿病患者和老年患者。美国和加拿大相关研究[11-12]报道,医院获得性链球菌血流感染(HASBSI) 在链球菌血流感染中的构成比分别为4.0%、12.4%,另一项基于多国的无乳链球菌血流感染研究[13]中,28%为医院获得性感染,HASBSI发病率正逐渐升高。全国血流感染细菌耐药监测联盟(Bacterial Resistance Investigation Collaborative System, BRICS)报告和国外相关临床研究均提示链球菌血流感染发病率历年变化不大,但细菌耐药率却逐步上升,表现为对红霉素、克林霉素的耐药率居高不下,对喹诺酮类耐药率呈缓慢上升趋势,对青霉素的不敏感性正逐渐出现[14-18]。为充分了解链球菌血流感染患者的临床特征、危险因素、治疗结局、耐药现状和患者预后,提高对链球菌血流感染的认识,因此对2018—2021年华东地区某三级甲等教学医院链球菌血流感染病例进行回顾性分析。
1 对象与方法 1.1 研究对象本研究选取2018年1月—2021年12月华东地区某三级甲等教学医院收治的链球菌血培养阳性患者作为研究对象。纳入标准:(1)年龄≥18岁。(2)血培养链球菌阳性。(3)患者出现感染症状、体征,包括发热>38℃或低体温<36℃,可伴有寒战,并合并下列情况之一,①有入侵门户或迁徙病灶;②有全身中毒症状;③有皮疹或出血点、肝脾大、外周血中性粒细胞增多伴核左移,且无其他原因可以解释;④收缩压低于90 mmHg或者较原收缩压下降超过40 mmHg[19-20]。(4)患者住院治疗且临床资料完整。排除标准:血培养考虑为污染。本研究经浙江大学医学院附属第一医院伦理委员会审批(批号:IIT20230533A)。
1.2 相关定义医院获得性感染被定义为入院≥48 h后发生的感染,但转院患者在48 h以内再出现感染症状,且血培养链球菌阳性,被归为医院获得性感染;“发热待查”患者若在入院48 h后血培养链球菌阳性计为社区获得性链球菌血流感染(CASBSI)。免疫抑制人群指[21]:(1)使用激素(强的松或等效糖皮质激素>20 mg/d,14 d以上;累计剂量>600 mg);(2)血液系统恶性肿瘤或造血干细胞移植后;(3)实体肿瘤化学治疗(化疗)后;(4)实体脏器移植患者;(5)艾滋病(AIDS);(6)其他(如原发的免疫功能缺陷)。
1.3 资料收集查阅电子病历系统,收集患者临床资料:(1)一般信息,包括性别、年龄、职业等;(2)临床表现,包括症状、体征、感染部位、合并症及患者入院和出院诊断等;(3)诱发因素,如感染前拔牙、口腔感染性疾病、软组织创伤、手术、侵入性操作、免疫抑制剂使用史、糖皮质激素使用史等;(4)实验室检查,包括血常规、超敏C反应蛋白、降钙素原、红细胞沉降率、血总蛋白、血清蛋白、丙氨酸转氨酶、天冬氨酸转氨酶、肌酐、肾小球滤过率、脑钠肽等;(5)影像学检查,包括肺部CT、腹部CT、超声心动图等;(6)抗感染治疗,包括患者在发生血流感染之后经验性和针对性抗菌药物使用情况;(7)采用量化指标评估患者一般情况,用Charlson共病指数(Charlson comorbidity index, CCI)评估患者基础疾病情况,急性生理学与慢性健康状况评分系统Ⅱ(APACHE Ⅱ评分)评估患者病情严重程度,Pitt菌血症评分(Pitt bacteremia score, PBS)评估患者感染严重程度。PBS分数范围为0~14分,≥4分通常提示病情危重和死亡风险增加;PBS评分主要通过患者体温、血压、神志、机械通气和心脏骤停与否来评分,其中体温≤35℃或≥40℃计2分,体温为35.1~36.0℃或39.0~39.9℃计1分;血压<90 mmHg或使用升压药物计2分;患者意识模糊计1分,嗜睡计2分,昏迷计3分;患者机械通气计2分;患者出现心跳骤停计4分[22]。
1.4 细菌鉴定与药敏试验细菌鉴定和药敏检测使用VITEK 2 Compact全自动微生物鉴定系统(法国梅里埃)进行细菌鉴定和药敏试验,结果参照美国临床实验室标准化协会(CLSI)标准。
1.5 统计分析数据应用SPSS 26.0软件进行统计分析,本研究连续性变量分布采用均数±标准差、中位数(M)或四分位数间距表示;单因素分析中,若变量为连续性变量采用非参数秩和检验(偏态分布)或t检验(正态分布),分类变量采用χ2检验或者two-tailed Fisher检验,将单因素分析有统计学意义的因素纳入多因素分析中,多因素分析采用二元logistic回归模型。所有数据分析结果以P≤0.05为差异具有统计学意义。
2 结果 2.1 患者基本特征2018年1月—2021年12月该医院共收治189例链球菌血培养阳性患者。根据纳入与排除标准,排除38例患者,包括17例临床资料不完整,11例血培养考虑为污染,7例<18岁,3例重复;最后151例链球菌血流感染患者被纳入本研究。
151例患者中男性93例(61.59%),女性58例(38.41%),平均发病年龄为(55.5±17.9)岁,>60岁的患者人数最多,共69例(45.70%),女性患者50岁之后发病人数明显增加。38例HASBSI患者在31~40岁、61~70岁年龄段发病人数较多(各9例);131例CASBSI患者在61~70岁(28例)、>70岁(27例)年龄段发病人数较多,见图 1。本研究中2018、2019、2020及2021年的发病人数占比(年发病人数/总发病人数)分别是19.87%(30例)、27.81%(42例)、22.52%(34例)、29.80%(45例),每年发病率变化不明显;发病人数最多的季节是冬季(12月—次年2月),为44例(29.14%),其次是春季(3—5月)41例(27.15%),秋季(9—11月)36例(23.84%),夏季(6—8月)30例(19.87%),不同季节链球菌血流感染发病率比较,差异无统计学意义(P>0.05)。
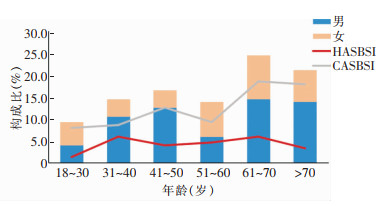 |
| 图 1 链球菌血流感染患者不同年龄段性别与感染类别分布 Figure 1 Distribution of genders and infection types of streptococcal bloodstream infection patients of different age groups |
151例患者中135例(89.40%)患有基础疾病,CCI平均为4.0±3.0,以实体肿瘤、心脏瓣膜疾病、高血压、肝胆疾病等较为多见,其中实体肿瘤包括肝癌7例,胆囊癌4例,胰腺癌4例,肺癌4例,肾癌3例等。本研究血流感染中具有明确感染来源的主要为肝胆来源(9.93%)、皮肤软组织(8.61%)、呼吸道(7.28%)等;回顾患者病史,35.10%患者血流感染的诱因未明,最常见的感染危险因素是手术(9.27%)、免疫抑制人群(9.27%)、皮肤黏膜完整性破坏(8.61%)、胆道结石(7.28%)等因素。研究中38例为(25.17%)HASBSI,HASBSI患者住院时间比CASBSI患者更长(P<0.001);发生HASBSI最常见的危险因素是手术、免疫抑制人群、有创机械通气(均P<0.001);HASBSI患者的APACHE Ⅱ评分高于CASBSI患者,差异有统计学意义(P<0.05)。见表 1。
| 表 1 链球菌血流感染患者临床特征 Table 1 Clinical characteristics of patients with streptococcal bloodstream infection |

|
经验治疗阶段,105例患者接受了抗菌药物单药治疗,主要为β-内酰胺酶抑制剂复方制剂(头孢哌酮/舒巴坦和哌拉西林/他唑巴坦)、碳青霉烯类和头孢菌素;46例患者接受了联合治疗,最常用的是碳青霉烯类联合糖肽类抗生素。目标治疗阶段,37例患者的治疗方案得到了调整,其中16例联合用药者改为单药治疗,主要变更为β-内酰胺酶抑制剂复方制剂或头孢菌素类。无患者接受青霉素治疗。在青霉素不敏感链球菌血流感染目标治疗组中β-内酰胺酶抑制剂复方制剂和碳青霉烯类使用最多。
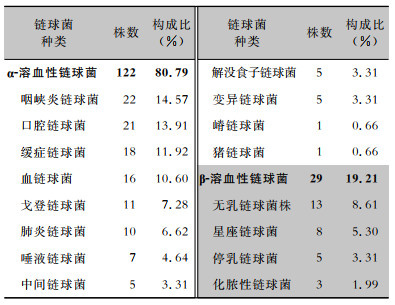
2.4 病原菌分布与药敏试验结果检出的151株链球菌中,α-溶血性链球菌占比最多达80.79%,主要为咽峡炎链球菌(14.57%)、口腔链球菌(13.91%)、缓症链球菌(11.92%)等;β-溶血性链球菌29株(19.21%),主要为无乳链球菌株(8.61%)、星座链球菌(5.30%)等。见表 2。
| 表 2 链球菌血流感染患者分离的链球菌菌株分类 Table 2 Classification of Streptococcus spp. isolated from patients with streptococcal bloodstream infection |
|
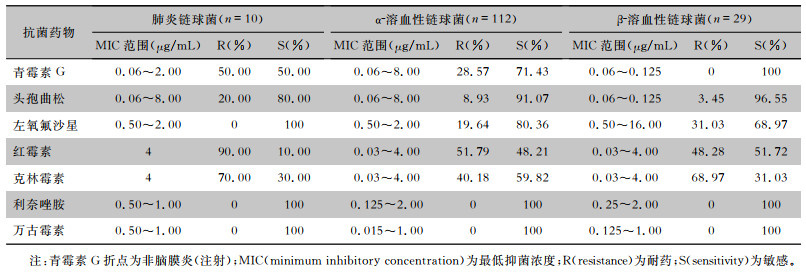
β-溶血性链球菌对青霉素完全敏感,α-溶血性链球菌(不包含肺炎链球菌)对青霉素的不敏感率为28.57%(32株),其中缓症链球菌8株,唾液链球菌7株,口腔链球菌8株,血链球菌4株,戈登链球菌2株,咽峡炎链球菌、嵴链球菌、中间链球菌各1株;对青霉素不敏感的α-溶血性链球菌血流感染患者当中有13例患者为HASBSI。链球菌对红霉素、克林霉素的耐药率较高,其中肺炎链球菌、α-溶血性链球菌(不包含肺炎链球菌)、β-溶血性链球菌对红霉素的耐药率分别为90.00%、51.79%和48.28%,对克林霉素的耐药率分别为70.00%、40.18%和68.97%。见表 3。
| 表 3 血流感染链球菌对常见抗菌药物的药敏结果 Table 3 Susceptibility results of streptococcal bloodstream infection strains to commonly used antimicrobial agents |
|
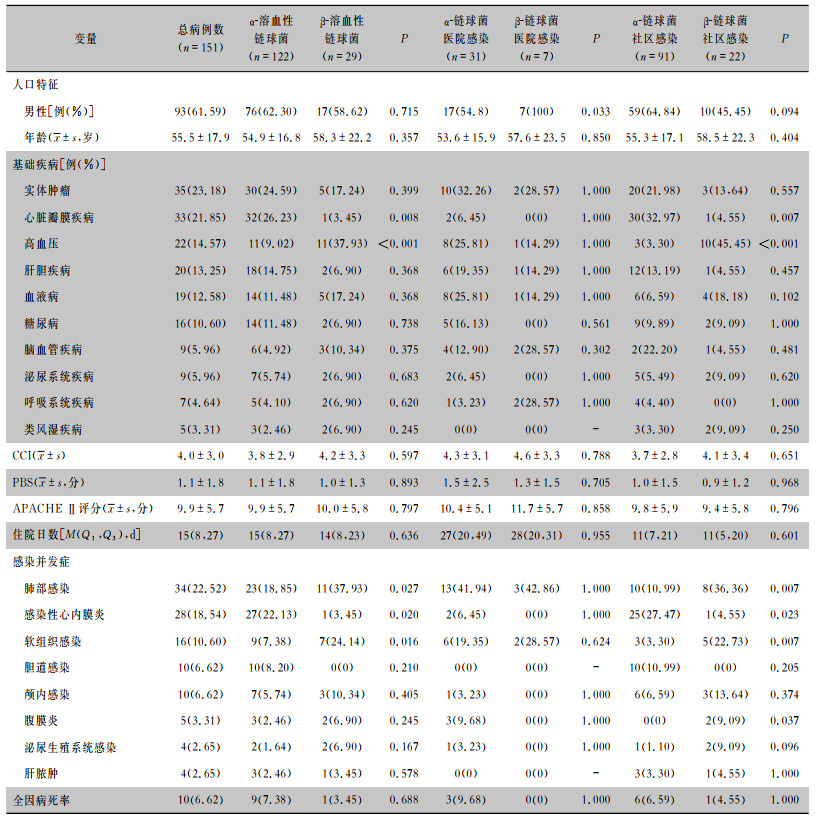
α-溶血性链球菌与β-溶血性链球菌血流感染患者及医院感染患者的年龄比较,差异无统计学意义(P>0.05)。α-溶血性链球菌血流感染患者常见基础疾病包括心脏瓣膜病或实体肿瘤,感染并发症包括感染性心内膜炎、肺部感染、软组织感染和胆道感染等;β-溶血性链球菌血流感染患者常见基础疾病包括实体肿瘤或血液病,软组织感染、肺部感染、颅内感染是其常见的感染并发症。通过比较α-溶血性链球菌与β-溶血性链球菌在医院感染和社区感染方面的差异,发现社区感染患者在基础疾病、感染并发症中存在明显差异,即社区获得性α-溶血性链球菌血流感染患者常伴瓣膜病,且容易合并感染性心内膜炎,而社区获得性β-溶血性链球菌血流感染患者常伴高血压且容易合并肺部感染、软组织感染和腹膜炎。见表 4。
| 表 4 α-溶血性链球菌与β-溶血性链球菌血流感染患者临床特征比较 Table 4 Comparison in clinical characteristics between patients with α-hemolytic Streptococcus and β-hemolytic Streptococcus bloodstream infection |
|
本研究进一步分析常见链球菌特征,发现咽峡炎链球菌血流感染(22例)以社区获得性为主,且63.64%(14例)患者有肝胆胰疾病(其中胆道结石6例,胰腺癌3例,胰腺炎2例,肝癌1例等);缓症链球菌(18例)血流感染以医院获得性为主,且多见于血液病患者(38.89%);血链球菌(16例)血流感染多发生于具有瓣膜异常的患者中,且并发感染性心内膜炎较多(56.25%)。患肝胆疾病患者20例,并发链球菌血流感染的菌株类型主要是咽峡炎链球菌(6株)、戈登链球菌(3株)、血链球菌(3株)等。
2.6 患者结局及预后分析151例患者中,93.38%(141例)患者临床感染治愈,6.62%(10例)患者死亡,全因病死率为6.62%,归因病死率为2.65%(4例)。通过单因素分析得出心力衰竭、肺部感染、酸碱失衡或电解质紊乱、休克、胸腔积液、呼吸衰竭、APACHE Ⅱ评分≥15分、PBS≥4分是患者死亡的影响因素(均P<0.05),见表 5。将单因素分析中有统计学意义的因素(P<0.05)作为自变量,以链球菌血流感染患者预后作为因变量进行二元logistic回归分析,得出休克(OR=13.690,95%CI:1.482~126.470)、PBS≥4分(OR=10.461,95%CI:1.042~105.005)是链球菌血流感染患者死亡的独立危险因素(均P<0.05)。见表 6。
| 表 5 链球菌血流感染患者预后单因素分析 Table 5 Univariate analysis of prognosis of patients with streptococcal bloodstream infection |
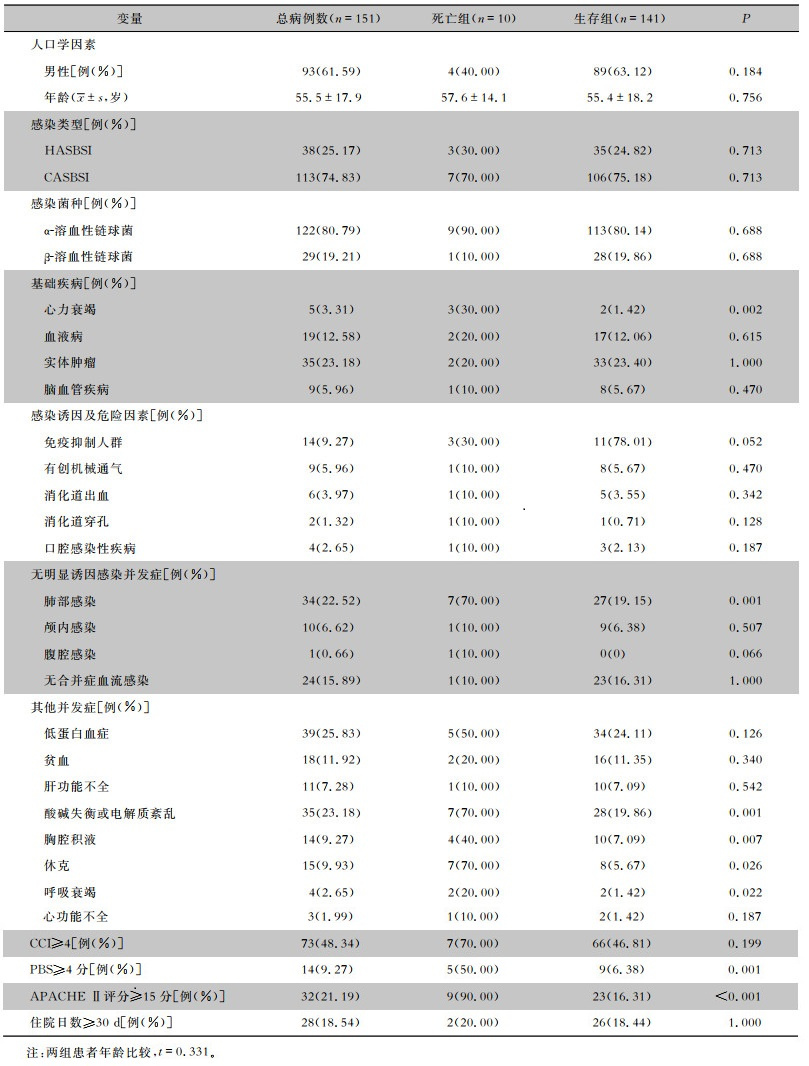
|
| 表 6 链球菌血流感染患者预后的二元logistic回归分析 Table 6 Binary logistic regression analysis of prognosis of patients with streptococcal bloodstream infection |
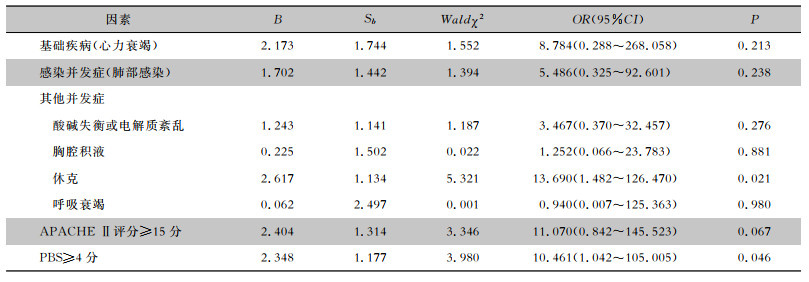
|
本研究中链球菌血流感染患者群体以男性为主,各个年龄段均有发病,平均发病年龄(55.5岁)明显低于日本研究[23]的发病年龄(67.4岁),但与英国的研究[10]持平(54岁)。患者中89.41%有基础疾病,常见的包括实体肿瘤(23.18%)、心脏瓣膜疾病(21.85%)、肝胆疾病(13.25%)和血液病(12.58%)等,以上基础疾病与文献[10]报道相似,但有所不同,文献[10, 23-25]报道较为常见的基础疾病为实体肿瘤(32.1%~58.0%)、糖尿病(14.0%~33.3%)、心力衰竭(4.0%~13.2%)等,但均提示链球菌血流感染更容易发生于具有基础疾病的患者。
本研究显示,实体肿瘤、肝胆疾病是发生链球菌血流感染患者最常见的基础疾病,同时也是发生医院感染的危险因素,这与法国的研究[26]结果相似。本研究进一步发现患有肝胆疾病(20例)的患者并发链球菌血流感染的菌株类型主要是咽峡炎链球菌(6株)、戈登链球菌(3株)、血链球菌(3株)等,此菌株分布结果也与上述研究结果相符[26]。链球菌血流感染与肝胆疾病相关的原因可能与门静脉-体循环侧支循环形成相关,这使得在胃肠道定植的链球菌容易入血[27],慢性肝脏疾病患者需对此加以关注。
链球菌是具有强侵袭能力和许多毒力因子的机会性致病菌,常定植于人体皮肤黏膜、口咽部和胃肠道等部位[3, 28],皮肤黏膜完整性破坏、口腔疾病、上消化道出血或穿孔是本研究发生CASBSI的危险因素,这可能是因为患者皮肤黏膜的完整性破坏给链球菌提供了可侵入的窗口,导致定植在皮肤黏膜中的链球菌随破损部位的血管进入血液循环,当患者的免疫细胞未能及时清除时,就容易导致血流感染[29]。气管插管、ERCP为HASBSI的常见危险因素,这可能是因为以上操作对人体呼吸道或胃肠道黏膜的机械刺激和黏膜造成损伤,导致人体天然屏障破坏,链球菌容易移位至无菌部位并发生感染[18, 30]。
近年研究[31-32]发现,非新生儿无乳链球菌血流感染发病率逐渐升高,尤其是在恶性肿瘤、免疫抑制人群、糖尿病或者老年患者中,本研究结果与上述研究相符。研究[10]指出草绿色链球菌属容易导致恶性肿瘤和免疫抑制人群发生血流感染,且大多数感染来源不明。本研究中免疫抑制人群或恶性肿瘤患者也容易出现无明显病灶的血流感染,病原菌主要为缓症链球菌、口腔链球菌等,属于草绿色链球菌属,符合上述研究结论。同时也有相关研究[23-24, 33-34]指出,咽峡炎链球菌属易产生胸部感染(如支气管肺炎、脓胸、肺脓肿)、肛周脓肿、颅内感染等,本研究中咽峡炎链球菌属血流感染患者合并颅内脓肿、纵隔感染、胆道感染和肝脓肿等感染并发症。在感染性心内膜炎致病菌中,草绿色链球菌较为多见,其中血链球菌被认为是感染性心内膜炎重要的病原菌[35],本研究中16例血链球菌血流感染患者中9例被确诊为感染性心内膜炎。不同链球菌感染部位的特异性有待继续研究。
早期充分的抗菌治疗是改善链球菌血流感染患者预后的关键,治疗持续时间通常为5~8 d[36],青霉素G是成人链球菌侵袭性感染的一线治疗药物,若患者青霉素过敏,可考虑使用头孢菌素类抗生素,在青霉素、头孢菌素等β-内酰胺类抗生素不敏感或过敏时推荐使用万古霉素、利奈唑胺等抗菌药物。本研究中,28.57%(32/112)的α-溶血性链球菌感染患者(肺炎链球菌除外)出现青霉素敏感性降低。回顾出现青霉素敏感性降低患者的临床病史,仅1例患者无基础疾病,其余31例患者均有基础疾病或3个月内抗菌药物使用史,其中40.63%患者为HASBSI,通过治疗,93.75%(30例)患者感染治愈,6.25%(2例)患者死亡。链球菌感染病死率与β-内酰胺类抗生素MIC升高相关性的数据有限,一项有关链球菌感染性心内膜炎研究[37]指出,链球菌β-内酰胺类抗生素耐药与较高的病死率相关。究其青霉素敏感性降低原因,Mao等[30]报道了临床分离的化脓性链球菌因为青霉素结合蛋白2X(PBP2X)基因错义突变从而与抗菌药物亲和力下降,导致对青霉素、氨苄西林、阿莫西林和头孢噻肟的MIC升高。
本研究经验性治疗患者中,单药治疗较多,主要使用β-内酰胺酶抑制剂复方制剂、碳青霉烯类、头孢菌素类等抗生素,其余30.46%患者为联合治疗,以碳青霉烯类联合糖肽类抗生素为主;在目标治疗阶段治疗方案基本与经验治疗相似。现阶段我国血流感染流行病学研究[38-39]显示革兰阴性菌逐渐增多,认为对脓毒症、免疫功能低下、中性粒细胞缺乏的患者,应经验性覆盖多重耐药的革兰阴性菌,故碳青霉烯类抗生素、β-内酰胺酶抑制剂复方制剂(头孢哌酮/舒巴坦、哌拉西林/他唑巴坦)是较好的选择,这与本研究在经验性治疗阶段使用β-内酰胺酶抑制剂复方制剂、碳青霉烯类联合糖肽类抗生素较多的情况相符。但是本研究中抗菌药物整体使用起点较高,需要进一步规范。芬兰的一项链球菌血流感染治疗研究[40]中指出感染专家会诊(infectious diseases specialist consultation,IDSC)有助于规范链球菌治疗方案,在IDSC介入的病例中,57.3% 的患者接受了青霉素G治疗,而无IDSC介入组中仅为22.5%,IDSC介入组中使用克林霉素作为辅助抗菌药物的比率(54.7%)高于无IDSC介入组(21.7%),差异有统计学意义(P<0.001);且IDSC介入组病死率低于无IDSC介入组,因此在发生血流感染时可通过感染科会诊商讨抗菌药物治疗方案以达到最佳治疗效果。本研究中,68.87%(104例)患者在非感染科接受治疗,但36例患者所在科室向感染科请求会诊协助,得到了合理治疗,整体感染预后良好。
本研究全因病死率为6.62%,归因病死率为2.65%;通过二元logistic回归分析得出休克、PBS≥4分是链球菌血流感染患者死亡的独立危险因素,这与之前相关研究结果相符,且研究结果包含了PBS,量化评估有助于临床客观实施。我国一项链球菌血流感染研究中[41]患者病死率为19%,休克、呼吸衰竭、白蛋白、纤维蛋白原是链球菌血流感染患者死亡的独立危险因素;泰国链球菌血流感染研究[42]中病死率为16.4%,PBS高、无发热为患者死亡的独立危险因素;西方国家的链球菌血流感染患者病死率为11%[12],其预后影响因素有待进一步探究。本研究结果表明PBS≥4分是链球菌血流感染患者死亡的危险因素,因为PBS中包括了患者体温、是否休克、是否心跳骤停、是否机械通气、神志情况,可以直接反映患者感染严重程度。最近研究[43]证实,PBS不仅可以评估血流感染患者病情,还能用于非菌血症感染患者病情,进一步证明了PBS在临床感染中的作用,且PBS在临床中可以通过体格检查直接获得,其便利性和预测性可指导临床识别高风险患者。
本研究存在局限性,首先作为回顾性研究,本研究存在一定的信息偏倚和选择偏倚;其次单中心研究存在患者样本数量较少,患者群体可能与其他地区的患者群体存在系统差异的缺点,因此结论的泛化能力有限,不能代表整个群体;且本研究未进行更深层次的分子生物学研究来探讨链球菌各分型流行病学趋势和耐药机制。
研究发现,链球菌血流感染主要以社区获得性为主,中老年男性患者占比较高,患者大部分有基础疾病,休克、PBS≥4分是链球菌血流感染患者死亡的独立危险因素,在链球菌血流感染的治疗过程中存在抗菌药物使用起点过高现象,患者整体预后良好。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Carapetis JR, Steer AC, Mulholland EK, et al. The global burden of group A streptococcal diseases[J]. Lancet Infect Dis, 2005, 5(11): 685-694. DOI:10.1016/S1473-3099(05)70267-X |
| [2] |
O'Loughlin RE, Roberson A, Cieslak PR, et al. The epidemiology of invasive group A streptococcal infection and potential vaccine implications: United States, 2000-2004[J]. Clin Infect Dis, 2007, 45(7): 853-862. DOI:10.1086/521264 |
| [3] |
Walker MJ, Barnett TC, McArthur JD, et al. Disease manifestations and pathogenic mechanisms of group A Streptococcus[J]. Clin Microbiol Rev, 2014, 27(2): 264-301. DOI:10.1128/CMR.00101-13 |
| [4] |
Ballard MS, Schønheyder HC, Knudsen JD, et al. The changing epidemiology of group B Streptococcus bloodstream infection: a multi-national population-based assessment[J]. Infect Dis (Lond), 2016, 48(5): 386-391. DOI:10.3109/23744235.2015.1131330 |
| [5] |
Asam D, Spellerberg B. Molecular pathogenicity of Streptococcus anginosus[J]. Mol Oral Microbiol, 2014, 29(4): 145-155. DOI:10.1111/omi.12056 |
| [6] |
Villalón P, Sáez-Nieto JA, Rubio-López V, et al. Invasive Streptococcus pyogenes disease in Spain: a microbiological and epidemiological study covering the period 2007-2019[J]. Eur J Clin Microbiol Infect Dis, 2021, 40(11): 2295-2303. DOI:10.1007/s10096-021-04279-2 |
| [7] |
Graux E, Hites M, Martiny D, et al. Invasive group B Streptococcus among non-pregnant adults in brussels-capital region, 2005-2019[J]. Eur J Clin Microbiol Infect Dis, 2021, 40(3): 515-523. DOI:10.1007/s10096-020-04041-0 |
| [8] |
Kern WV, Rieg S. Burden of bacterial bloodstream infection-a brief update on epidemiology and significance of multidrug-resistant pathogens[J]. Clin Microbiol Infect, 2020, 26(2): 151-157. DOI:10.1016/j.cmi.2019.10.031 |
| [9] |
Montassier E, Batard E, Gastinne T, et al. Recent changes in bacteremia in patients with cancer: a systematic review of epidemiology and antibiotic resistance[J]. Eur J Clin Microbiol Infect Dis, 2013, 32(7): 841-850. DOI:10.1007/s10096-013-1819-7 |
| [10] |
Shelburne SA 3rd, Tarrand J, Rolston KV. Review of streptococcal bloodstream infections at a comprehensive cancer care center, 2000-2011[J]. J Infect, 2013, 66(2): 136-146. DOI:10.1016/j.jinf.2012.11.007 |
| [11] |
Daneman N, McGeer A, Low DE, et al. Hospital-acquired invasive group a streptococcal infections in Ontario, Canada, 1992-2000[J]. Clin Infect Dis, 2005, 41(3): 334-342. DOI:10.1086/431589 |
| [12] |
Laupland KB, Pasquill K, Parfitt EC, et al. Bloodstream infection due to β-hemolytic Streptococci: a population-based comparative analysis[J]. Infection, 2019, 47(6): 1021-1025. DOI:10.1007/s15010-019-01356-9 |
| [13] |
Francois Watkins LK, McGee L, Schrag SJ, et al. Epidemiology of invasive group B streptococcal infections among nonpregnant adults in the United States, 2008-2016[J]. JAMA Intern Med, 2019, 179(4): 479-488. DOI:10.1001/jamainternmed.2018.7269 |
| [14] |
陈云波, 嵇金如, 应超群, 等. 2016至2017年全国血流感染细菌耐药监测(BRICS)报告[J]. 中华临床感染病杂志, 2020, 13(1): 42-54. Chen YB, Ji JR, Ying CQ, et al. BRICS report of 2016-2017: the distribution and antimicrobial resistance profile of clinical isolates from blood culture in China[J]. Chinese Journal of Clinical Infectious Diseases, 2020, 13(1): 42-54. DOI:10.3760/cma.j.issn.1674-2397.2020.01.011 |
| [15] |
陈云波, 嵇金如, 应超群, 等. 2018至2019年度全国血流感染细菌耐药监测报告[J]. 中华临床感染病杂志, 2021, 14(1): 32-45. Chen YB, Ji JR, Ying CQ, et al. BRICS report of 2018-2019: the distribution and antimicrobial resistance profile of clinical isolates from blood culture in China[J]. Chinese Journal of Clinical Infectious Diseases, 2021, 14(1): 32-45. DOI:10.3760/cma.j.issn.1674-2397.2021.01.007 |
| [16] |
陈云波, 嵇金如, 应超群, 等. 2020年全国血流感染细菌耐药监测(BRICS)报告[J]. 中华临床感染病杂志, 2021, 14(6): 413-426. Chen YB, Ji JR, Ying CQ, et al. BRICS report of 2020: the bacterial composition and antimicrobial resistance profile of clinical isolates from bloodstream infections in China[J]. Chinese Journal of Clinical Infectious Diseases, 2021, 14(6): 413-426. DOI:10.3760/cma.j.issn.1674-2397.2021.06.002 |
| [17] |
Southon SB, Beres SB, Kachroo P, et al. Population genomic molecular epidemiological study of macrolide-resistant Streptococcus pyogenes in Iceland, 1995 to 2016: identification of a large clonal population with a pbp2x mutation conferring reduced in vitro β-lactam susceptibility[J]. J Clin Microbiol, 2020, 58(9): e00638-20. |
| [18] |
李刚, 郭睿, 王文, 等. 2014—2019年咽峡炎链球菌群血流感染临床特点及其耐药性分析[J]. 中国感染与化疗杂志, 2020, 20(5): 476-480. Li G, Guo R, Wang W, et al. Clinical characteristics and antibiotic resistance profiles of Streptococcus anginosus group bloodstream infection from 2014 to 2019[J]. Chinese Journal of Infection and Chemotherapy, 2020, 20(5): 476-480. |
| [19] |
中华人民共和国卫生部. 医院感染诊断标准(试行)[J]. 中华医学杂志, 2001, 81(5): 314-320. Ministry of Health of the People's Republic of China. Diagnostic criteria for nosocomial infections (proposed)[J]. Natio-nal Medical Journal of China, 2001, 81(5): 314-320. DOI:10.3760/j:issn:0376-2491.2001.05.027 |
| [20] |
Evans L, Rhodes A, Alhazzani W, et al. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock 2021[J]. Intensive Care Med, 2021, 47(11): 1181-1247. DOI:10.1007/s00134-021-06506-y |
| [21] |
Hill AT. Management of community-acquired pneumonia in immunocompromised adults: a consensus statement regarding initial strategies[J]. Chest, 2020, 158(5): 1802-1803. DOI:10.1016/j.chest.2020.08.003 |
| [22] |
Chow JW, Yu VL. Combination antibiotic therapy versus monotherapy for Gram-negative bacteraemia: a commentary[J]. Int J Antimicrob Agents, 1999, 11(1): 7-12. DOI:10.1016/S0924-8579(98)00060-0 |
| [23] |
Suzuki H, Hase R, Otsuka Y, et al. Bloodstream infections caused by Streptococcus anginosus group bacteria: a retrospective analysis of 78 cases at a Japanese tertiary hospital[J]. J Infect Chemother, 2016, 22(7): 456-460. DOI:10.1016/j.jiac.2016.03.017 |
| [24] |
Jiang SH, Li M, Fu T, et al. Clinical characteristics of infections caused by Streptococcus anginosus group[J]. Sci Rep, 2020, 10(1): 9032. DOI:10.1038/s41598-020-65977-z |
| [25] |
Rantala S. Streptococcus dysgalactiae subsp. equisimilis bacteremia: an emerging infection[J]. Eur J Clin Microbiol Infect Dis, 2014, 33(8): 1303-1310. DOI:10.1007/s10096-014-2092-0 |
| [26] |
Bert F, Bariou-Lancelin M, Lambert-Zechovsky N. Clinical significance of bacteremia involving the "Streptococcus milleri" group: 51 cases and review[J]. Clin Infect Dis, 1998, 27(2): 385-387. DOI:10.1086/514658 |
| [27] |
Bannatyne RM, Stringel G, Simpson JS. Spontaneous peritonitis due to group B Streptococci[J]. Can Med Assoc J, 1979, 121(4): 442-443. |
| [28] |
刘贞艳, 毕振强. A群链球菌病原学与流行病学研究进展[J]. 中华流行病学杂志, 2014, 35(6): 752-754. Liu ZY, Bi ZQ. A review on the advancement of etiology and epidemiology of group A Streptococcus[J]. Chinese Journal of Epidemiology, 2014, 35(6): 752-754. DOI:10.3760/cma.j.issn.0254-6450.2014.06.031 |
| [29] |
Chhatwal G, Graham R. Streptococcal diseases[J]. Int Encycl Public Health, 2008, 1(5439): 231-241. |
| [30] |
Mao P, Peng P, Liu ZY, et al. Risk factors and clinical outcomes of hospital-acquired MRSA infections in Chongqing, China[J]. Infect Drug Resist, 2019, 12: 3709-3717. DOI:10.2147/IDR.S223536 |
| [31] |
Skoff TH, Farley MM, Petit S, et al. Increasing burden of invasive group B streptococcal disease in nonpregnant adults, 1990-2007[J]. Clin Infect Dis, 2009, 49(1): 85-92. DOI:10.1086/599369 |
| [32] |
Bergseng H, Rygg M, Bevanger L, et al. Invasive group B Streptococcus (GBS) disease in Norway 1996-2006[J]. Eur J Clin Microbiol Infect Dis, 2008, 27(12): 1193-1199. DOI:10.1007/s10096-008-0565-8 |
| [33] |
Claridge JE 3rd, Attorri S, Musher DM, et al. Streptococcus intermedius, Streptococcus constellatus, and Streptococcus anginosus ("Streptococcus milleri group") are of different clinical importance and are not equally associated with abscess[J]. Clin Infect Dis, 2001, 32(10): 1511-1515. DOI:10.1086/320163 |
| [34] |
Furuichi M, Horikoshi Y. Sites of infection associated with Streptococcus anginosus group among children[J]. J Infect Chemother, 2018, 24(2): 99-102. DOI:10.1016/j.jiac.2017.09.011 |
| [35] |
Beteille E, Guarana M, Nucci M. Infective endocarditis in neutropenic patients with viridans Streptococci bacteraemia[J]. Clin Microbiol Infect, 2018, 24(8): 916-917. DOI:10.1016/j.cmi.2018.03.012 |
| [36] |
Timsit JF, Ruppé E, Barbier F, et al. Bloodstream infections in critically ill patients: an expert statement[J]. Intensive Care Med, 2020, 46(2): 266-284. DOI:10.1007/s00134-020-05950-6 |
| [37] |
Pilmis B, Lourtet-Hascoёt J, Barraud O, et al. Be careful about MICs to amoxicillin for patients with Streptococci-related infective endocarditis[J]. Int J Antimicrob Agents, 2019, 53(6): 850-854. DOI:10.1016/j.ijantimicag.2019.03.002 |
| [38] |
Giannella M, Bartoletti M, Gatti M, et al. Advances in the therapy of bacterial bloodstream infections[J]. Clin Microbiol Infect, 2020, 26(2): 158-167. DOI:10.1016/j.cmi.2019.11.001 |
| [39] |
《β-内酰胺类抗生素/β-内酰胺酶抑制剂复方制剂临床应用专家共识》编写专家组. β-内酰胺类抗生素/β-内酰胺酶抑制剂复方制剂临床应用专家共识(2020年版)[J]. 中华医学杂志, 2020, 100(10): 738-747. Expert consensus writing group for The expert consensus on clinical application of compound preparations of β-lactam antibiotics/β-lactamase inhibitors. Expert consensus on clinical app-lication of compound preparations of β-lactam antibiotics/β-lactamase inhibitors (2020 edition)[J]. National Medical Journal of China, 2020, 100(10): 738-747. DOI:10.3760/cma.j.cn112137-20200202-00178 |
| [40] |
Vilhonen J, Vuopio J, Vahlberg T, et al. Group A streptococcal bacteremias in southwest Finland 2007-2018: epidemiology and role of infectious diseases consultation in antibiotic treatment selection[J]. Eur J Clin Microbiol Infect Dis, 2020, 39(7): 1339-1348. DOI:10.1007/s10096-020-03851-6 |
| [41] |
Duan XG, Zhang RF, Zhang XJ, et al. Identification of prognostic factors in patients with streptococcus bloodstream infection[J]. Front Med (Lausanne), 2022, 9: 832007. |
| [42] |
Vasikasin V, Changpradub D. Clinical manifestations and prognostic factors for Streptococcus agalactiae bacteremia among nonpregnant adults in Thailand[J]. J Infect Chemother, 2021, 27(7): 967-971. DOI:10.1016/j.jiac.2021.02.010 |
| [43] |
Henderson H, Luterbach CL, Cober E, et al. The Pitt bacteremia score predicts mortality in nonbacteremic infections[J]. Clin Infect Dis, 2020, 70(9): 1826-1833. DOI:10.1093/cid/ciz528 |



