Clinical characteristics and antimicrobial resistance of Gram-negative bacterial infection in elderly patients with peritoneal dialysis-related peritonitis
-
摘要:
目的 回顾性分析老年腹膜透析相关性腹膜炎(PDRP)革兰阴性(G-)菌的病原菌分布、耐药性变化及相关临床特征,为临床诊疗提供参考依据。 方法 收集2015年1月—2022年12月某市3所三级甲等医院就诊治疗的老年PDRP患者,对G-菌PDRP的病原菌分布、耐药性、PDRP发病率、临床特征及预后进行分析。 结果 共有247例老年腹膜透析(PD)患者发生PDRP 406例次;PD老年患者PDRP总发病率和革兰阳性(G+)菌PDRP的发病率均呈逐年下降趋势(均P<0.05),而G-菌PDRP发病率随年份变化无明显下降趋势(P>0.05)。PD老年患者共发生G-菌PDRP 96例(106例次),以大肠埃希菌为主(38.68%)。与2015—2018年相比,2019—2022年老年PDRP患者分离的G-菌对哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、亚胺培南、美罗培南、阿米卡星敏感率无明显变化,均高度敏感;对头孢噻肟的耐药率增加(P=0.033)。多因素logistic回归分析显示,血清C反应蛋白高、腹膜透析液第1天白细胞计数高、腹膜透析液白细胞计数降至正常的时间长是老年PD患者发生G-菌PDRP的危险因素(均P<0.05)。G-菌组老年PDRP患者的治愈率(83.96%)低于G+菌组(93.01%),差异有统计学意义(P<0.05)。 结论 PD老年患者G-菌PDRP发病率无明显下降趋势,氨基糖苷类抗生素可作为G-菌PDRP经验性治疗的首选药物。 Abstract:Objective To retrospectively analyze the distribution and antimicrobial resistance changes of Gram-negative (G-) bacteria, as well as related clinical characteristics of peritoneal dialysis-related peritonitis (PDRP) in elderly patients, provide reference for clinical diagnosis and treatment. Methods Elderly PDRP patients in three tertiary first-class hospitals in a city from January 2015 to December 2022 were analyzed, distribution and antimicrobial resistance of G- bacterial PDRP pathogens, as well as incidence, clinical characteristics and prognosis of PDRP were analyzed. Results A total of 247 elderly peritoneal dialysis (PD) patients developed 406 episodes of PDRP. The overall incidence and incidence of Gram-positive (G+) bacterial PDRP in elderly PD patients showed a downward trend year by year (both P < 0.05), while the incidence of G- bacterial PDRP showed no significant downward trend (P>0.05). A total of 96 cases (106 episodes) of G- bacterial PDRP occurred in elderly PD patients, with Escherichia coli being the predominant strain (38.68%). Compared with 2015-2018, there was no significant change in the susceptibility rates of G- bacteria isolated from elderly PDRP patients to piperacillin/tazobactam, cefo- perazone/sulbactam, imipenem, meropenem, and amikacin in 2019-2022, all of which were highly susceptible. The resistance rate to cefotaxime increased (P=0.033). Multivariate logistic regression analysis showed that high serum C-reactive protein, high white blood cell count in PD fluid on the first day, and long time for white blood cell count in PD fluid to return to normal were risk factors for G- bacterial PDRP in elderly PD patients (all P < 0.05). The cure rate of elderly PDRP patients in G- bacterial group (83.96%) was lower than that of the G+ bacterial group (93.01%), with statistically difference (P < 0.05). Conclusion There is no obvious downward trend in the incidence of G- bacterial PDRP in elderly PD patients, aminoglycosides can be used as the first choice for empirical treatment of G- bacterial PDRP. -
随着全球范围人口老龄化,终末期肾脏病(end stage renal disease, ESRD)老年患者数量不断增多,腹膜透析(peritoneal dialysis, PD)是针对ESRD患者的肾脏替代疗法之一,对老年、幼儿及偏远地区的患者具有更好的适用性。研究[1]显示我国PD人群中,老年患者占比已超过15%,未来会逐步上升至40%,因此改善老年患者PD对提升ESRD患者生存率具有重大意义。腹膜透析相关性腹膜炎(peritoneal dialysis-related peritonitis, PDRP)是PD常见且严重的并发症,是导致PD技术失败及患者死亡的主要原因,尤其是老年患者,PDRP是其死亡的独立危险因素之一[2]。目前研究[3-4]表明PDRP的病原菌及耐药情况在PD发展过程中不断发生变化;尤其老年PD患者基础疾病多,病情复杂,抗菌药物使用频繁,而不同地区经验性使用抗菌药物不同,故不同地区具有不同的病原菌分布和耐药性。近年多篇文献[5-6]报道,PD患者革兰阳性(G+)菌腹膜炎发生率显著下降,而革兰阴性(G-)菌腹膜炎发生率逐渐增加。研究[4, 7]表明,G-菌腹膜炎会增加治疗失败率,导致患者拔除PD导管,永久性转入血液透析,甚至死亡;与非老年PD患者相比,老年PD患者G-菌腹膜炎发生率更高[8]。因此,在老年PDRP患者中,早期明确病原菌种类及耐药情况有助于制定合理的初始治疗方案,缩短治疗时间,提高治疗效果。目前国内大部分研究主要关注PDRP患者G+菌与G-菌的占比以及相关药敏结果分析,对G-菌种类的研究开展较少。因此本研究回顾性分析老年PDRP患者G-菌感染的病原菌分布、耐药性变化及相关临床特征,为早期识别老年PDRP患者的病原菌类型、制定经验性抗感染方案提供参考依据。
1. 对象与方法
1.1 研究对象
收集2015年1月—2022年12月攀枝花学院附属医院、攀枝花市中心医院、攀钢总医院就诊治疗的老年PDRP患者为研究对象。纳入标准:①接受维持性非卧床PD治疗的老年慢性肾衰竭患者(年龄≥60岁);②PD时间≥3个月;③临床资料完整;④符合2016年国际腹膜透析学会(International Society for Peritoneal Dialysis, ISPD)制定的PDRP诊断标准[7],具备以下3项中的2项或以上者:腹膜透析液浑浊伴腹痛和(或)发热;透出液检测白细胞计数(WBC)>100×106/L,其中中性粒细胞比率>50%;透出液病原菌培养结果为阳性。排除标准:①合并其他部位感染;②合并恶性肿瘤;③长期服用免疫抑制剂;④肝功能不全者;⑤入院前已接受抗菌药物治疗;⑥混合感染。
1.2 细菌培养及药敏试验
所有纳入患者治疗前先留取透出液标本(一般留取首袋出现浑浊的透出液;若无法留取首袋浑浊透出液,则透析液至少存腹2 h再留取标本)。无菌操作取10 mL透出液进行常规检查;另外取50 mL透出液,离心留取沉淀,用5 mL无菌生理盐水悬浮,然后分别注入需氧和厌氧血培养瓶内,使用法国Bact/Alert 3D全自动血培养仪进行培养,培养阳性者转种至血平板和麦康凯平板上继续培养,直至分离出单个纯菌落,再使用VITEK 2 Compact全自动微生物鉴定与药敏分析系统进行病原菌种类鉴定及药敏试验。药敏结果采用美国临床实验室标准化协会(CLSI) 2014年的标准进行判读,结果分为敏感(S)、中介(I)、耐药(R)三种情况,根据临床抗菌药物选用原则,本文只统计分析S和R。
1.3 质控菌株
铜绿假单胞菌ATCC 27853、金黄色葡萄球菌ATCC 25923、大肠埃希菌ATCC 25922。
1.4 资料收集
回顾性收集纳入患者资料,包括性别、年龄,PD时间,血WBC、血红蛋白、血肌酐、总蛋白、血钾、血钙、血磷、血清C反应蛋白(CRP),腹膜透析液第1天WBC、腹膜透析液WBC降至正常的时间。
1.5 PDRP发病率计算及G-菌分布分析
PDRP发病率=纳入患者的年PDRP例次数/ ∑(每例纳入患者的年PD天数/365.25)[9],比较2015—2022年透出液G-菌组与G+菌组PDRP发病率;比较2015—2018年与2019—2022年的G-菌PDRP的病原菌分布。
1.6 治疗方案及效果
PDRP初始治疗方案为头孢唑林联合头孢他啶或头孢曲松,然后再根据透出液病原菌培养结果调整抗菌药物。采用ISPD制定的《腹膜炎预防治疗指南》判断疗效[10],治愈:临床症状完全消失,无需抗感染治疗,无需拔除腹膜透析管,1个月内无复发;死亡:患者因活动性腹膜炎死亡或在腹膜炎发生后2周内死亡;退出PD:拔除腹膜透析管转入血液透析治疗或因其他原因死亡。治疗失败包括退出PD和死亡。
1.7 统计学方法
应用WHONET 5.6软件对细菌药敏结果进行分析。数据统计分析应用SPSS 17.0统计学软件,定量资料以均数±标准差表示,两组间比较采用t检验;定性资料采用构成比或率进行描述,采用Fisher确切概率法或卡方检验进行比较;G-菌所致PDRP的影响因素采用多因素logistic回归分析;腹膜炎发生率采用Poisson回归分析。以P≤0.05为差异具有统计学意义。
2. 结果
2.1 病原菌分布及构成比
共纳入2015—2022年247例老年PDRP患者,发生PDRP 406例次,其中病原菌培养阳性的PDRP 384例次,病原菌培养阴性的PDRP 22例次。G+菌PDRP共272例次,以凝固酶阴性葡萄球菌为主(134例次,49.26%)。G-菌PDRP共106例次,以大肠埃希菌为主(41例次,38.68%),其次为肺炎克雷伯菌(22例次,20.75%)、阴沟肠杆菌(12例次,11.32%)。真菌性腹膜炎共6例次,以白念珠菌为主(3例次,50.00%)。见表 1。
表 1 老年PD患者PDRP病原体分布及构成比Table 1 Distribution and constituent ratios of PDRP pathogens from elderly PD patients病原体 例次 构成比(%) G+菌 272 70.83 凝固酶阴性葡萄球菌 134 34.90 链球菌属 56 14.58 金黄色葡萄球菌 32 8.33 肠球菌属 22 5.73 其他 28 7.29 G-菌 106 27.61 大肠埃希菌 41 10.68 肺炎克雷伯菌 22 5.73 阴沟肠杆菌 12 3.13 鲍曼不动杆菌 5 1.30 铜绿假单胞菌 4 1.04 鲁氏不动杆菌 3 0.78 其他 19 4.95 真菌 6 1.56 白念珠菌 3 0.78 近平滑念珠菌 2 0.52 光滑念珠菌 1 0.26 合计 384 100 2.2 老年PDRP的发病率
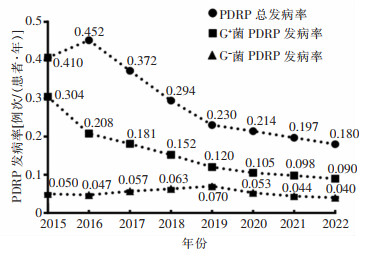
2015—2022年老年PDRP的总发病率为(0.180~0.452)例次/(患者·年),且随年份变化呈下降趋势,差异有统计学意义(P=0.035);G+菌PDRP发病率呈逐年下降趋势,差异有统计学意义(P=0.005),从2015年的0.304例次/(患者·年)下降至0.090例次/(患者·年);G-菌PDRP发病率为(0.04~0.07)例次/(患者·年),差异无统计学意义(P=0.225)。见图 1。
2.3 G-菌PDRP发生情况
2.3.1 患者一般资料
2015—2022年共发生G-菌PDRP 96例(106例次),其中女性49例(51.04%),男性47例(48.96%);平均年龄为(64.57±12.33)岁;原发疾病为慢性肾小球肾炎36例(37.50%),糖尿病肾病29例(30.21%),高血压肾损伤10例(10.42%),多囊肾8例(8.33%),梗阻性肾病5例(5.21%),狼疮性肾炎3例(3.12%),病因未明5例(5.21%)。
2.3.2 G-菌分布
2015—2018年与2019—2022年检出的引起PDRP的G-菌构成比比较,差异无统计学意义(P>0.05);2019—2022年引起PDRP的大肠埃希菌占比较高(45.95%)。见表 2。
表 2 2015—2018年和2019—2022年老年PDRP患者分离的G-菌分布[株(%)]Table 2 Distribution of G- bacteria isolated from elderly PDRP patients in 2015-2018 and 2019-2022 (No. of isolates [%])G-菌 全部 2015—2018年 2019—2022年 大肠埃希菌 41(38.68) 7(21.87) 34(45.95) 肺炎克雷伯菌 22(20.76) 10(31.25) 12(16.22) 阴沟肠杆菌 12(11.32) 4(12.50) 8(10.81) 鲍曼不动杆菌 5(4.72) 1(3.13) 4(5.41) 铜绿假单胞菌 4(3.77) 1(3.13) 3(4.05) 鲁氏不动杆菌 3(2.83) 1(3.13) 2(2.70) 其他 19(17.93) 8(25.00) 11(14.86) 合计 106(100) 32(100) 74(100) 2.3.3 G-菌药敏结果
在临床常用的各种抗菌药物中,G-菌对哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、亚胺培南、美罗培南、阿米卡星保持敏感,敏感率分别为92.45%、94.34%、97.17%、98.11%、97.17%;与2015—2018年相比,2019—2022年G-菌对头孢噻肟的耐药率增加,差异有统计学意义(P=0.033),对其他常用抗菌药物的耐药率差异均无统计学意义(均P>0.05)。见表 3。
表 3 2015—2018年和2019—2022年老年PDRP患者分离的G-菌药敏结果(%)Table 3 Antimicrobial susceptibility testing results of G- bacteria isolated from elderly PDRP patients in 2015-2018 and 2019-2022 (%)抗菌药物 全部(n=106) 2015—2018年(n=32) 2019—2022年(n=74) χ2 P R S R S R S 哌拉西林/他唑巴坦 7.55 92.45 3.12 96.88 9.46 90.54 3.043 0.456 头孢呋辛 27.36 72.64 31.25 68.75 25.68 74.32 1.905 0.234 头孢他啶 19.81 80.19 15.62 84.38 21.62 78.38 7.923 0.081 头孢噻肟 20.75 79.25 15.62 84.38 22.97 77.03 8.076 0.033 头孢哌酮/舒巴坦 5.66 94.34 3.12 96.88 6.76 93.24 1.933 0.376 头孢西丁 32.08 67.92 34.37 65.63 31.08 68.92 2.046 0.189 亚胺培南 2.83 97.17 0 100 4.05 95.95 1.843 0.420 美罗培南 0 98.11 0 100 0 97.30 2.650 0.383 阿米卡星 2.83 97.17 6.25 93.75 1.35 98.65 5.343 0.156 左氧氟沙星 18.87 81.13 15.62 84.38 20.27 79.73 2.305 0.246 环丙沙星 26.42 73.58 28.12 71.88 25.68 74.32 1.763 0.321 莫西沙星 46.23 53.77 43.75 56.25 47.30 52.70 12.350 0.300 复方磺胺甲 
47.17 52.83 43.75 56.25 48.65 51.35 3.146 0.181 2.3.4 G-菌PDRP老年患者临床指标情况
与G+菌组PDRP老年患者比较,G-菌组患者PD时间、腹膜透析液第1天WBC、腹膜透析液WBC降至正常时间和血清CRP均明显增高,差异均有统计学意义(均P<0.05)。见表 4。
表 4 两组PDRP患者的临床指标情况(x ± s)Table 4 Clinical indicators of two groups of PDRP patients (x ± s)指标 G-菌组(n=106) G+菌组(n=272) χ2/t P 年龄(岁) 65.35±13.08 63.22±11.75 4.233 0.742 PD时间(月) 23.40±22.06 22.60±20.86 1.062 0.041 WBC(×109/L) 8.03±4.05 8.25±5.72 0.923 0.303 血红蛋白(g/L) 98.07±23.02 101.72±22.70 0.057 0.527 血肌酐(mol/L) 787.53±306.24 815.42±277.82 1.579 0.084 总蛋白(g/L) 53.63±6.76 54.80±7.42 0.105 0.923 清蛋白(g/L) 27.03±5.33 28.01±6.03 0.802 0.541 血钾(mmol/L) 3.62±0.65 3.58±0.70 0.705 0.681 血钙(mmol/L) 2.05±0.23 2.07±0.21 3.223 0.502 血磷(mmol/L) 1.55±0.72 1.57±0.82 2.342 0.358 血清CRP(mg/L) 120.50±82.06 89.50±75.67 3.524 <0.001 腹膜透析液第1天WBC (×109/L) 8.58±19.05 3.41±10.51 6.756 <0.001 腹膜透析液WBC降至正常时间(d) 6.07±4.10 4.23±2.50 5.113 <0.001 2.3.5 PD老年患者发生G-菌PDRP的多因素分析
以PDRP G-菌感染作为因变量,以PD时间、腹膜透析液第1天WBC、腹膜透析液WBC降至正常时间和血清CRP为自变量进行多因素logistic回归分析,结果表明血清CRP高、腹膜透析液第1天WBC高、腹膜透析液WBC降至正常的时间长是老年G-菌PDRP的危险因素(均P<0.05)。见表 5。
表 5 PD老年患者发生G-菌PDRP的多因素logistic回归分析Table 5 Multivariate logistic regression analysis on G- bacterial PDRP in elderly PD patients变量 Sb P OR 95%CI PD时间(月) 0.017 0.340 1.350 0.942~1.010 血清CRP(mg/L)* 1.609 <0.001 1.503 1.010~1.042 腹膜透析液第1天WBC(×109/L)* 0.962 <0.001 1.540 1.260~1.603 腹膜透析液WBC降至正常时间(d) 0.114 <0.005 1.402 1.025~1.178 注:*表示数值采用log10。 2.4 预后分析
G-菌组PDRP患者共治愈89例次,治愈率为83.96%;治疗失败17例次(17例,其中退出PD转入血液透析10例,死亡7例),治疗失败率为16.04%。G+菌组PDRP患者共治愈253例次,治愈率为93.01%;治疗失败19例次(19例,其中退出PD转入血液透析12例,死亡7例),治疗失败率为6.99%。G-菌组PDRP患者治愈率(83.96%) 低于G+菌组(93.01%),差异有统计学意义(χ2=8.532,P=0.027)。
3. 讨论
PD作为ESRD替代治疗的重要方法之一,具有操作简单、血流动力学稳定、可居家治疗等优点,特别适合老年ESRD患者。PDRP是PD的严重并发症之一,是导致PD技术失败及患者死亡的重要原因;此外,老年PD患者具有更高的共病负担,故老年患者在PDRP期间病情更加复杂,且研究[2]显示年龄是影响PDRP预后的重要因素,因此在临床上防治老年PDRP备受关注。
本研究2015—2022年老年PDRP总发病率波动在(0.180~0.452)次/(患者·年),且随年份变化呈下降趋势(P=0.035)。G+菌仍是老年PDRP患者的主要致病菌,其中以凝固酶阴性葡萄球菌为主,与既往研究[3]结果类似,但G+菌PDRP发病率呈逐年下降趋势(P=0.005);而G-菌PDRP发病率无明显下降趋势(P=0.225)。另有研究[4]显示,在未按年龄分层的PDRP患者中,G-菌PDRP发病率随年份变化呈逐年上升趋势,G-菌检出率占比高达32.5%;以上研究说明G-菌已成为PDRP的重要致病菌。G-菌PDRP的病原菌以大肠埃希菌为主;与2015—2018年相比,2019—2022年大肠埃希菌引起的PDRP占比较高,与国内外研究[11-12]一致,考虑与老年患者更易发生肠道功能紊乱相关,当发生腹泻、便秘、低钾血症时,肠道细菌可能透过肠壁引起PDRP。因此临床应加强健康宣教,如避免不洁饮食、保持大便通畅、及时诊治肠道感染等,以降低老年PD患者G-菌感染的风险。
经验性抗菌药物的选择对于治疗PDRP非常重要。研究[13]发现抗菌药物的使用直接影响腹膜炎的预后,但不可避免地诱导细菌产生耐药性,这已严重威胁到全球公共卫生系统[14]。因此,定期分析抗菌药物的耐药性,对指导临床合理用药、改善预后以及避免加重细菌耐药性具有重要意义。根据2016年ISPD指南中的建议,本研究对PDRP采用的初始治疗方案为头孢唑林联合头孢他啶或头孢曲松。研究期间,G-菌对哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、亚胺培南、美罗培南、阿米卡星保持敏感;进一步分析发现,与2015—2018年相比,2019—2022年G-菌对头孢噻肟的耐药性显著增加(P=0.033),与Kitterer等[15]报道结果相似;这与G-菌在抗菌药物诱导下发生基因突变,产生β-半乳糖苷酶的突变体对头孢菌素产生耐药性有关[16]。本研究碳青霉烯类抗生素对G-菌具有持续的有效性;但碳青霉烯类抗生素的使用可能增加菌群失衡和双重感染的风险,因此,不建议将碳青霉烯类抗生素作为G-菌PDRP初始治疗的首选药物。氨基糖苷类抗生素具有肾毒性,限制了其临床使用,但现有研究[17]报道氨基糖苷类抗生素的使用与残余肾功能的丢失加剧无关;ISPD指南也提出短期、间歇腹腔内给予氨基糖苷类抗生素对PDRP患者安全有效;本研究结果也显示,PDRP分离的G-菌对阿米卡星高度敏感。因此,针对G-菌PDRP,氨基糖苷类抗生素可作为经验性治疗的首选药物。
研究[18-19]发现,G-菌PDRP发展为难治性腹膜炎的风险比G+菌高5.2倍,且炎症反应更重,预后更差。本次回顾性研究也有相似发现,在老年PDRP患者中,G-菌PDRP的预后较G+菌差,治愈率降低(P=0.027)。因此,针对G-菌PDRP应尽早使用抗菌药物控制感染,减轻炎症损伤。然而,腹膜透析透出液细菌培养及药敏试验需要时间,故分析不同致病菌的临床及实验室表现,有利于经验性指导临床选用抗菌药物。本研究单因素分析发现,G-菌组的PD时间、血清CRP、腹膜透析液第1天WBC、腹膜透析液WBC降至正常时间明显高于G+菌组;经多因素回归分析后显示,血清CRP、腹膜透析液第1天WBC、腹膜透析液WBC降至正常时间与PDRP致病菌类型有关。研究[4]显示,腹膜透析液WBC水平与腹膜炎的严重程度直接相关,WBC峰值发生在腹膜炎的第1天,G-菌感染后第1天腹膜透析液WBC明显高于G+菌感染;张禹[8]研究还发现,G-菌引起的腹腔感染,细胞因子免疫反应延迟,腹膜透析液WBC的变化趋势与引起腹膜炎病原菌的类型有关。因此,腹膜透析液第1天WBC增高、腹膜透析液WBC降至正常时间延长与G-菌感染有关。血清CRP是机体在急性炎症反应过程中产生的一种急性时相蛋白,是体内炎症反应的可靠准确标志物;赵晶等[20]指出,CRP升高在G-菌PDRP患者中最为显著。故高水平的CRP提示老年PD患者G-菌感染可能性大。此外,既往研究[21-22]发现在未按年龄分层的PD患者中,长时间PD可能导致肠道屏障功能及通透性改变,继而引起肠道来源的G-菌感染,而血钾也是影响G-菌PDRP的独立危险因素之一;但本次研究显示,G-菌与G+菌PDRP患者的PD时间和血钾水平差异均无统计学意义,可能与本研究中纳入的患者数量较少以及PD时间与相关报道不同有关,因此PD时间及血钾水平是否与G-菌PDRP有关,尚需多中心、大数据前瞻性研究进一步确认。
综上所述,在老年PD患者中,G-菌PDRP发病率无明显下降趋势;研究期间,G-菌对头孢噻肟的耐药性增加,根据药敏结果,氨基糖苷类抗生素可作为经验性治疗的首选药物;G-菌PDRP治愈率低于G+菌;血清CRP、腹膜透析液第1天WBC、腹膜透析液WBC降至正常时间与PDRP致病菌类型有关。
致谢:感谢攀枝花市攀钢总医院检验科李德中医生在收集数据时提供的帮助,感谢攀枝花学院基础医学院预防教研室张弋老师对数据分析的指导。 -
表 1 老年PD患者PDRP病原体分布及构成比
Table 1 Distribution and constituent ratios of PDRP pathogens from elderly PD patients
病原体 例次 构成比(%) G+菌 272 70.83 凝固酶阴性葡萄球菌 134 34.90 链球菌属 56 14.58 金黄色葡萄球菌 32 8.33 肠球菌属 22 5.73 其他 28 7.29 G-菌 106 27.61 大肠埃希菌 41 10.68 肺炎克雷伯菌 22 5.73 阴沟肠杆菌 12 3.13 鲍曼不动杆菌 5 1.30 铜绿假单胞菌 4 1.04 鲁氏不动杆菌 3 0.78 其他 19 4.95 真菌 6 1.56 白念珠菌 3 0.78 近平滑念珠菌 2 0.52 光滑念珠菌 1 0.26 合计 384 100 表 2 2015—2018年和2019—2022年老年PDRP患者分离的G-菌分布[株(%)]
Table 2 Distribution of G- bacteria isolated from elderly PDRP patients in 2015-2018 and 2019-2022 (No. of isolates [%])
G-菌 全部 2015—2018年 2019—2022年 大肠埃希菌 41(38.68) 7(21.87) 34(45.95) 肺炎克雷伯菌 22(20.76) 10(31.25) 12(16.22) 阴沟肠杆菌 12(11.32) 4(12.50) 8(10.81) 鲍曼不动杆菌 5(4.72) 1(3.13) 4(5.41) 铜绿假单胞菌 4(3.77) 1(3.13) 3(4.05) 鲁氏不动杆菌 3(2.83) 1(3.13) 2(2.70) 其他 19(17.93) 8(25.00) 11(14.86) 合计 106(100) 32(100) 74(100) 表 3 2015—2018年和2019—2022年老年PDRP患者分离的G-菌药敏结果(%)
Table 3 Antimicrobial susceptibility testing results of G- bacteria isolated from elderly PDRP patients in 2015-2018 and 2019-2022 (%)
抗菌药物 全部(n=106) 2015—2018年(n=32) 2019—2022年(n=74) χ2 P R S R S R S 哌拉西林/他唑巴坦 7.55 92.45 3.12 96.88 9.46 90.54 3.043 0.456 头孢呋辛 27.36 72.64 31.25 68.75 25.68 74.32 1.905 0.234 头孢他啶 19.81 80.19 15.62 84.38 21.62 78.38 7.923 0.081 头孢噻肟 20.75 79.25 15.62 84.38 22.97 77.03 8.076 0.033 头孢哌酮/舒巴坦 5.66 94.34 3.12 96.88 6.76 93.24 1.933 0.376 头孢西丁 32.08 67.92 34.37 65.63 31.08 68.92 2.046 0.189 亚胺培南 2.83 97.17 0 100 4.05 95.95 1.843 0.420 美罗培南 0 98.11 0 100 0 97.30 2.650 0.383 阿米卡星 2.83 97.17 6.25 93.75 1.35 98.65 5.343 0.156 左氧氟沙星 18.87 81.13 15.62 84.38 20.27 79.73 2.305 0.246 环丙沙星 26.42 73.58 28.12 71.88 25.68 74.32 1.763 0.321 莫西沙星 46.23 53.77 43.75 56.25 47.30 52.70 12.350 0.300 复方磺胺甲 
47.17 52.83 43.75 56.25 48.65 51.35 3.146 0.181 表 4 两组PDRP患者的临床指标情况(x ± s)
Table 4 Clinical indicators of two groups of PDRP patients (x ± s)
指标 G-菌组(n=106) G+菌组(n=272) χ2/t P 年龄(岁) 65.35±13.08 63.22±11.75 4.233 0.742 PD时间(月) 23.40±22.06 22.60±20.86 1.062 0.041 WBC(×109/L) 8.03±4.05 8.25±5.72 0.923 0.303 血红蛋白(g/L) 98.07±23.02 101.72±22.70 0.057 0.527 血肌酐(mol/L) 787.53±306.24 815.42±277.82 1.579 0.084 总蛋白(g/L) 53.63±6.76 54.80±7.42 0.105 0.923 清蛋白(g/L) 27.03±5.33 28.01±6.03 0.802 0.541 血钾(mmol/L) 3.62±0.65 3.58±0.70 0.705 0.681 血钙(mmol/L) 2.05±0.23 2.07±0.21 3.223 0.502 血磷(mmol/L) 1.55±0.72 1.57±0.82 2.342 0.358 血清CRP(mg/L) 120.50±82.06 89.50±75.67 3.524 <0.001 腹膜透析液第1天WBC (×109/L) 8.58±19.05 3.41±10.51 6.756 <0.001 腹膜透析液WBC降至正常时间(d) 6.07±4.10 4.23±2.50 5.113 <0.001 表 5 PD老年患者发生G-菌PDRP的多因素logistic回归分析
Table 5 Multivariate logistic regression analysis on G- bacterial PDRP in elderly PD patients
变量 Sb P OR 95%CI PD时间(月) 0.017 0.340 1.350 0.942~1.010 血清CRP(mg/L)* 1.609 <0.001 1.503 1.010~1.042 腹膜透析液第1天WBC(×109/L)* 0.962 <0.001 1.540 1.260~1.603 腹膜透析液WBC降至正常时间(d) 0.114 <0.005 1.402 1.025~1.178 注:*表示数值采用log10。 -
[1] 李阳, 王海云, 王颖, 等. 老年腹膜透析患者长期生存分析[J]. 中华肾脏病杂志, 2017, 33(1): 1-7. doi: 10.3760/cma.j.issn.1001-7097.2017.01.001 Li Y, Wang HY, Wang Y, et al. Long-term survival analysis of the elderly peritoneal dialysis patients[J]. Chinese Journal of Nephrology, 2017, 33(1): 1-7. doi: 10.3760/cma.j.issn.1001-7097.2017.01.001 [2] Jiang CL, Zheng Q. Outcomes of peritoneal dialysis in elderly vs non-elderly patients: a systemic review and Meta-analysis[J]. PLoS One, 2022, 17(2): e0263534. doi: 10.1371/journal.pone.0263534 [3] McGuire AL, Carson CF, Inglis TJJ, et al. Effects of a statewide protocol for the management of peritoneal dialysis-related peritonitis on microbial profiles and antimicrobial susceptibilities: a retrospective five-year review[J]. Perit Dial Int, 2015, 35(7): 722-728. doi: 10.3747/pdi.2014.00117 [4] Zeng Y, Jiang LS, Lu Y, et al. Peritoneal dialysis-related pe-ritonitis caused by Gram-negative organisms: ten-years expe-rience in a single center[J]. Ren Fail, 2021, 43(1): 993-1003. doi: 10.1080/0886022X.2021.1939050 [5] Gadola L, Poggi C, Dominguez P, et al. Risk factors and prevention of peritoneal dialysis-related peritonitis[J]. Perit Dial Int, 2019, 39(2): 119-125. doi: 10.3747/pdi.2017.00287 [6] Feng XR, Yang X, Yi CY, et al. Escherichia coli peritonitis in peritoneal dialysis: the prevalence, antibiotic resistance and clinical outcomes in a South China dialysis center[J]. Perit Dial Int, 2014, 34(3): 308-316. doi: 10.3747/pdi.2013.00012 [7] 孟令飞, 朱学研, 杨立明, 等. 腹膜透析相关腹膜炎患者治疗失败预测模型的构建和验证: 一项多中心临床研究[J]. 南方医科大学学报, 2022, 42(4): 546-553. Meng LF, Zhu XY, Yang LM, et al. Development and validation of a prediction model for treatment failure in peritoneal dia- lysis-associated peritonitis patients: a multicenter study[J]. Journal of Southern Medical University, 2022, 42(4): 546-553. [8] 张禹. 老年腹膜透析相关性腹膜炎的临床特点及其治疗失败的预测模型构建与验证[D]. 长春: 吉林大学, 2021. Zhang Y. Clinical characteristics and development and validation of a predictive model for the treatment failure in elderly patients with peritoneal dialysis associated peritonitis[D]. Changchun: Jilin University, 2021. [9] Marshall MR, Waters GP, Verger C. Simplified calculation of peritoneal dialysis-associated peritonitis rate: Accuracy of a recently developed estimating equation[J]. Perit Dial Int, 2023, 43(5): 411-416. doi: 10.1177/08968608231154156 [10] Li PKT, Szeto CC, Piraino B, et al. ISPD peritonitis recommendations: 2016 update on prevention and treatment[J]. Perit Dial Int, 2016, 36(5): 481-508. doi: 10.3747/pdi.2016.00078 [11] Lin WH, Tseng CC, Wu AB, et al. Clinical and microbiological characteristics of peritoneal dialysis-related peritonitis caused by Escherichia coli in southern Taiwan[J]. Eur J Clin Microbiol Infect Dis, 2018, 37(9): 1699-1707. doi: 10.1007/s10096-018-3302-y [12] 汤立, 沈平, 胡钦凤, 等. 老年腹膜透析相关性腹膜炎的致病菌与预后特点分析[J]. 中华肾病研究电子杂志, 2018, 7(5): 211-216. Tang L, Shen P, Hu QF, et al. Analysis of pathogens and prognosis in the elderly patients with peritoneal dialysis-related peritonitis[J]. Chinese Journal of Kidney Disease Investigation(Electronic Edition), 2018, 7(5): 211-216. [13] Htay H, Cho Y, Pascoe EM, et al. Center effects and peritoneal dialysis peritonitis outcomes: analysis of a national registry[J]. Am J Kidney Dis, 2018, 71(6): 814-821. doi: 10.1053/j.ajkd.2017.10.017 [14] Francine P. Systems biology: new insight into antibiotic resis-tance[J]. Microorganisms, 2022, 10(12): 2362. doi: 10.3390/microorganisms10122362 [15] Kitterer D, Latus J, Pöhlmann C, et al. Microbiological surveillance of peritoneal dialysis associated peritonitis: antimicrobial susceptibility profiles of a referral center in Germany over 32 years[J]. PLoS One, 2015, 10(9): e0135969. doi: 10.1371/journal.pone.0135969 [16] Tooke CL, Hinchliffe P, Bragginton EC, et al. β-Lactamases and β-lactamase inhibitors in the 21st century[J]. J Mol Biol, 2019, 431(18): 3472-3500. doi: 10.1016/j.jmb.2019.04.002 [17] Badve SV, Hawley CM, McDonald SP, et al. Use of amino-glycosides for peritoneal dialysis-associated peritonitis does not affect residual renal function[J]. Nephrol Dial Transplant, 2012, 27(1): 381-387. doi: 10.1093/ndt/gfr274 [18] 邢虎, 张亚峰, 刘大东, 等. 难治性腹膜透析相关性腹膜炎发生的影响因素与风险评分模型研究[J]. 中华医院感染学杂志, 2019, 29(20): 3175-3179. Xing H, Zhang YF, Liu DD, et al. Analysis of influencing factors and establishment of risk scoring model for refractory peritoneal dialysis-associated peritonitis[J]. Chinese Journal of Nosocomiology, 2019, 29(20): 3175-3179. [19] Al Sahlawi M, Zhao JH, McCullough K, et al. Variation in peritoneal dialysis-related peritonitis outcomes in the peritoneal dialysis outcomes and practice patterns study (PDOPPS)[J]. Am J Kidney Dis, 2022, 79(1): 45-55. e1. doi: 10.1053/j.ajkd.2021.03.022 [20] Yin SP, Tang M, Rao ZS, et al. Risk factors and pathogen spectrum in continuous ambulatory peritoneal dialysis-associa-ted peritonitis: a single center retrospective study[J]. Med Sci Monit, 2022, 28: e937112. [21] 赵晶, 杨立明, 朱学研, 等. 长腹膜透析龄患者首次腹膜炎的临床特征及治疗转归: 基于4家医院625例患者数据[J]. 南方医科大学学报, 2020, 40(12): 1740-1746. Zhao J, Yang LM, Zhu XY, et al. Clinical characteristics and treatment outcomes of first peritonitis in patients receiving long-term peritoneal dialysis: a multicenter study[J]. Journal of Southern Medical University, 2020, 40(12): 1740-1746. [22] Wang HH, Huang CH, Kuo MC, et al. Microbiology of peritoneal dialysis-related infection and factors of refractory peritoneal dialysis related peritonitis: a ten-year single-center study in Taiwan[J]. J Microbiol Immunol Infect, 2019, 52(5): 752-759. doi: 10.1016/j.jmii.2018.10.013

 下载:
下载:
