Application of combined detection of Mycobacterium tuberculosis-specific IFN-γ and IL-2 in the differential diagnosis of pulmonary tuberculosis and bacterial pneumonia
-
摘要:
目的 评价结核分枝杆菌特异性细胞因子干扰素-γ(IFN-γ)、白细胞介素-2(IL-2)双因子联合检测在肺结核与细菌性肺炎鉴别诊断中的应用价值。 方法 选择阜阳市人民医院2022年1月—2023年10月呼吸科住院患者91例,明确诊断为肺结核患者45例(肺结核组)和细菌性肺炎患者46例(肺炎组),均进行双因子联合检测,比对分析双因子联合检测与C反应蛋白(CRP)对肺结核和细菌性肺炎鉴别诊断的效果。 结果 使用双因子联合检测对肺结核与细菌性肺炎进行鉴别诊断,灵敏度为86.7%、特异度为84.8%,受试者工作特征曲线下面积(AUC)值为0.928(95%CI: 0.870~0.986),与CRP的鉴别诊断效果相比差异有统计学意义(P < 0.05)。 结论 结核分枝杆菌特异性细胞因子IFN-γ、IL-2联合检测在鉴别肺结核与细菌性肺炎时具有较高的应用价值,能为临床肺结核和细菌性肺炎的鉴别诊断提供依据。 Abstract:Objective To evaluate the application value of combined detection of Mycobacterium tuberculosis-specific cytokines interferon-γ (IFN-γ) and interleukin-2 (IL-2) in the differential diagnosis of pulmonary tuberculosis and bacterial pneumonia. Methods A total of 91 hospitalized patients in the respiratory department of Fuyang People's Hospital from January 2022 to October 2023 were selected. Forty-five patients were diagnosed with pulmonary tuberculosis (pulmonary tuberculosis group), and 46 patients were diagnosed with bacterial pneumonia (pneumonia group). Two-cytokine combined detection were performed on all patients. The effect of two-cytokine combined detection and C-reactive protein (CRP) in the differential diagnosis of pulmonary tuberculosis and bacterial pneumonia was compared. Results The sensitivity and specificity of two-cytokine combined detection for the differential diagnosis of pulmonary tuberculosis and bacterial pneumonia were 86.7% and 84.8%, respectively. The area under the receiver operating characteristic curve was 0.928 (95%CI: 0.870-0.986), which showed significant difference compared with differential diagnostic efficacy of CRP (P < 0.05). Conclusion The combined detection of Mycobacterium tuberculosis-specific cytokine IFN-γ and IL-2 in the differential diagnosis of pulmonary tuberculosis and bacterial pneumonia has a high application value, which can provide a basis for the differential diagnosis of pulmonary tuberculosis and bacterial pneumonia. -
Keywords:
- pulmonary tuberculosis /
- bacterial pneumonia /
- IFN-γ /
- IL-2 /
- combined detection /
- differential diagnosis
-
中国是结核病高负担国家,世界卫生组织(WHO)2023年发布的全球结核病报告[1]显示,2022年全球新发结核病1 060万例,中国新发结核病74.8万例,在30个高负担国家中排名第三。作为结核病发现的主要场所和哨点,约有50%以上的肺结核患者在综合医院初诊时发现,因此,加强综合医院结核病诊断能力是提升结核病防治水平的首要任务,特别是发现结核病的主要科室呼吸科[2-5]。肺结核是一种由结核分枝杆菌(TB)感染引起的肺部特异性疾病,因其发病及病变性质不同,病情及病期差异多样,可形成复杂的影像;与其它感染性肺炎相似,临床上均可出现发热、咳嗽、咳痰等症状,且影像学呈非特异性,均可出现炎性渗出、浸润、实变或索条影,因而经常被误诊,临床上早期鉴别诊断面临很大的挑战[6-7]。
目前肺结核主要依据细菌学、病理学、分子生物学检查等方法确诊,然而这些方法无法简单、快速、准确地鉴别肺结核与其它感染性肺炎。细菌性肺炎作为最常见的感染性肺炎,占成人各类病原体肺炎的80%,常见症状为发热、咳嗽、咳痰,或原有呼吸道症状加重,并出现脓性痰或血痰,临床症状、影像学不典型,往往需要与肺结核相区别[8]。因此,找到一种快速、准确、无创的鉴别肺结核与细菌性肺炎的诊断方法,对于肺结核的早发现、早治疗有着重大的意义。TB特异性细胞因子检测试剂盒(酶联免疫法)首次利用两种结核特异性细胞因子干扰素-γ(IFN-γ)和白细胞介素-2(IL-2)联合检测辅助诊断结核病,特别是菌阴结核病的特异性检出[9]。C反应蛋白(CRP)是由肝细胞产生的一种急性期反应蛋白,具有调节炎症过程和预防感染性疾病的作用,对感染性疾病具有较高的灵敏度,但特异度不高,有研究[10-11]表明CRP可作为肺结核与细菌性肺炎鉴别诊断的有效指标。本研究评估TB特异性IFN-γ和IL-2联合检测方法在综合性医院鉴别诊断肺结核与细菌性肺炎中的价值,避免临床医生对结核病的误诊,有助于肺结核的早发现、早治疗。
1. 对象与方法
1.1 研究对象
收集2022年1月—2023年10月阜阳市人民医院呼吸科住院患者,均进行TB特异性细胞因子IFN-γ和IL-2联合检测。纳入标准:①年龄≥14岁;②肺结核组为确诊肺结核及临床诊断为肺结核的病例;③肺炎组均按相应疾病的诊断标准进行诊断,并经临床诊断及鉴别诊断最终确诊。排除标准:①临床资料缺失;②陈旧性肺结核患者;③不明病原体感染的肺部感染疾病患者;④肺结核与细菌合并感染患者。本研究获得该医院道德伦理委员会批准[批号:2021(141号)],所有研究对象均签署知情同意书。
1.2 仪器与试剂
TB特异性细胞因子检测试剂盒(广州迪澳医疗科技有限公司);TB核酸扩增荧光检测试剂盒(中山大学达安基因股份有限公司);全自动微生物质谱鉴定系统microflex LT/SH(美国布鲁克);酶标仪DR-200Bn(无锡华卫德朗);CO2培养箱(日本松下);生物安全柜BSC-1500ⅡA2-X(济南鑫贝西生物技术有限公司);生物显微镜(徕卡);离心机(长沙湘智离心机仪器有限公司);荧光定量聚合酶链式反应(PCR)仪(上海宏石)。
1.3 研究方法
1.3.1 肺结核和细菌性肺炎诊断方法
肺结核诊断参照《肺结核诊断》WS 288—2017[12],以病原学(包括细菌学、分子生物学)检查为主,结合流行病史、临床表现、胸部影像、相关辅助检查及鉴别诊断等,进行综合分析做出诊断。细菌学检测是结核病诊断的“金标准”,主要包括痰TB培养和痰抗酸杆菌涂片染色显微镜检查:①涂片抗酸染色镜检采用直接涂片抗酸杆菌染色镜检法,具体操作过程按照《痰涂片镜检标准化操作及质量保证手册》要求进行;②TB核酸扩增荧光检测(TB-DNA检测)采用TB特异性引物和特异性荧光探针,配以PCR反应液、耐热DNA聚合酶、四种核苷酸单体等成分,通过PCR体外扩增法进行DNA扩增检测TB核酸。
细菌性肺炎诊断参照《中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)》[13],在临床诊断的基础上,若合格的下呼吸道分泌物、经支气管镜防污染毛刷、支气管肺泡灌洗液、肺组织或无菌体液培养出病原菌,且临床表现相符,可作为确定致病菌的依据。细菌分离培养与鉴定是细菌感染性疾病诊断的“金标准”。痰、支气管肺泡灌洗液等标本培养提纯后,采用全自动微生物质谱鉴定系统进行病原菌鉴定;或将支气管肺泡灌洗液经宏基因组二代测序(mNGS)技术确定病原体。
1.3.2 诊断试验检测方法
采集静脉血3~5 mL于真空管内送检,采用免疫比浊法检测血清CRP水平;采集4~6 mL外周血于含有肝素抗凝剂的采血管中,从全血中分离外周血单个核细胞(PBMC),在细胞培养板上每份标本设置阴性对照孔、蛋白刺激孔、阳性对照孔,每孔加入的细胞数量为2.5×105个。将细胞培养板放入37℃,5% CO2培养箱培养16~20 h。使用酶联免疫法分别对上清中的IFN-γ和IL-2进行浓度测定,并进行TB特异性细胞因子IFN-γ和IL-2联合检测;以测试孔减去阴性孔数值进行判读,参考标准为:IFN-γ<7 pg/mL且IL-2<20 pg/mL,定义为阴性结果;IFN-γ≥7 pg/mL且IL-2≥20 pg/mL,定义为双阳结果;IFN-γ≥7 pg/mL或IL-2≥20 pg/mL,定义为单阳结果。
1.4 统计分析
应用SPSS 26.0和GraphPad Prism 8.0软件对数据进行统计分析和图片绘制。正态分布计量资料以均数±标准差(x ±s)表示,组间比较采用t检验;非正态分布计量资料采用M(P25,P75)表示,组间比较采用Mann-Whitney U检验;计数资料以频数和百分率(%)描述,组间比较采用χ2检验。采用受试者工作特征(receiver opera-ting characteristic curve, ROC)曲线评估检测结果对肺结核与细菌性肺炎的鉴别诊断价值,以P≤0.05为差异有统计学意义。
2. 结果
2.1 患者基本特征
呼吸科收治疑似肺结核患者共91例,最终临床诊断或实验室确诊肺结核患者45例,纳入肺结核组,其中男性27例(60.0%),女性18例(40.0%),平均年龄(52.09±20.36)岁;细菌性肺炎患者46例,纳入肺炎组,其中男性26例(56.5%),女性20例(43.5%),平均年龄(60.46±16.43)岁;两组患者性别、平均年龄比较,差异均无统计学意义(均P>0.05)。见表 1。肺结核患者临床确诊3例,病原学确诊42例,其中分子生物学检测阳性35例(含抗酸染色阳性2例),mNGS检测到TB基因7例。肺炎组中,细菌性肺炎46例,分离细菌主要以铜绿假单胞菌(20株)、肺炎克雷伯菌(10株)、流感嗜血杆菌(8株)为主,其次为肺炎链球菌(3株)、鲍曼不动杆菌(2株),大肠埃希菌、金黄色葡萄球菌、棒状杆菌各1株。
表 1 两组患者基本特征Table 1 Basic characteristics of two groups of patients特征 肺结核组(n=45) 肺炎组(n=46) 平均年龄(岁) 52.09±20.36 60.46±16.43 男性[例(%)] 27(60.0) 26(56.5) 抗酸染色阳性(例) 2 0 TB-DNA阳性(例) 35 0 mNGS TB基因阳性 7 0 2.2 IFN-γ和IL-2联合检测结果
肺炎组IFN-γ、IL-2水平中位数分别为1.33(0.16,5.32)、0.59(0,1.88) pg/mL,均低于肺结核组[380.62(53.06,747.61)、81.28(7.81,244.47) pg/mL],差异均有统计学意义(均P < 0.001),见表 2。
表 2 两组患者IFN-γ、IL-2水平比较[M(P25,P75), pg/mL]Table 2 Comparison of IFN-γ and IL-2 levels between two groups of patients (M [P25, P75], pg/mL)指标 肺炎组(n=46) 肺结核组(n=45) Z P IFN-γ 1.33(0.16,5.32) 380.62(53.06,747.61) 7.036 < 0.001 IL-2 0.59(0,1.88) 81.28(7.81,244.47) 6.772 < 0.001 以IFN-γ≥7 pg/mL和/或IL-2≥20 pg/mL为阳性结果时,肺结核组患者IFN-γ和IL-2联合检测阳性39例,灵敏度为86.7%,其中IFN-γ、IL-2双阳结果32例,双阳灵敏度为71.1%。肺炎组中,双因子联合检测阴性结果39例,特异度为84.8%,无双阳结果,双阳特异度100%。见表 3。
表 3 两组患者IFN-γ和IL-2联合检测结果[例(%)]Table 3 Results of IFN-γ and IL-2 combined detection in two groups of patients (No. of cases [%])双因子联合检测 肺结核组(n=45) 肺炎组(n=46) 阳性 39(86.7) 7(15.2) IFN-γ阳性且IL-2阳性 32(71.1) 0(0) IFN-γ阳性或IL-2阳性 7(15.6) 7(15.2) 阴性 6(13.3) 39(84.8) 2.3 双因子联合检测与CRP水平对肺结核与细菌性肺炎鉴别诊断的效果
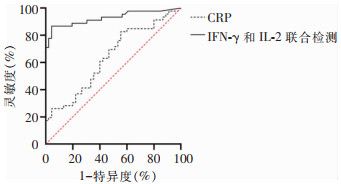
双因子联合检测、CRP水平对肺结核与细菌性肺炎鉴别诊断的ROC曲线下面积(AUC)值分别为0.928(95%CI: 0.870~0.986)、0.636(95%CI: 0.523~0.750),见图 1。肺结核患者CRP检测结果平均值为29.8 mg/L,细菌性肺炎患者CRP检测结果平均值为66.5 mg/L,细菌性肺炎患者的CRP结果高于肺结核患者(t=-2.461,P < 0.001)。CRP值以13.5为阈值时,灵敏度为60.0%,特异度为60.9%。双因子联合检测IFN-γ、IL-2阈值分别为19.97、19.84 pg/mL时,灵敏度、特异度分别为86.7%、95.5%,均高于CRP检测效果(χ2=182.346、351.123,均P < 0.001)。双因子联合检测对肺结核与细菌性肺炎鉴别诊断相较于CRP具有更高的价值。
3. 讨论
病原学阳性作为结核病确诊方法,需从标本中检测到TB才能确诊。但由于标本不合格、标本中未检测到或仅含有较少TB等原因,病原学检测阳性率低,需要更高效、灵敏、易获取检测标本的检测手段来鉴别病原学阴性的肺结核患者。对血标本进行免疫学检测优势明显,找到新的检测标志物尤为重要[14-15]。通过TB特异性细胞因子IFN-γ和IL-2联合检测鉴别诊断肺结核与细菌性肺炎的研究较少,活动性结核病(ATB)与潜伏性结核分枝杆菌感染(LTBI)的鉴别仍是γ-干扰素释放试验(IGRA)的局限性所在[16]。近些年,在IGRA中增加TB特异性细胞因子作为区分ATB和LTBI的生物标志物的研究越来越多,其中研究效果最好的为IL-2[17]。
感染性肺炎是常见的呼吸系统疾病,其中细菌感染性肺炎是最常见的感染类型,病程早期选取敏感炎性标志物来评估病情的严重程度, 对临床选取合适的抗菌药物、控制病情及评估临床预后具有重要意义。目前,临床通常以白细胞计数(WBC)、CRP及降钙素原(PCT)水平等诊断感染性疾病的经典指标结合患者体征来综合判断[18],也有研究将以上指标用于肺结核与感染性肺炎的鉴别诊断,但缺乏特异性。本研究对使用TB特异性细胞因子IFN-γ和IL-2联合检测及CRP检测来鉴别诊断肺结核与细菌性肺炎的效果进行评估。
本研究中,双因子联合检测的灵敏度为86.7%、特异度为84.8%,AUC值为0.928,相较CRP水平检测具有更好的检测效果,可以更好的为临床肺结核辅助诊断及与细菌性肺炎的鉴别诊断提供依据,并对临床上有TB感染症状,疑似肺结核,但没有病原学依据的肺部感染性疾病进行鉴别,排除TB感染。CRP作为感染性疾病常用指标,缺乏特异性,本研究使用了近些年新建立的TB特异性的免疫学方法IGRA,并在传统IGRA中增加了TB特异性细胞因子IL-2作为结核病检测指标,肺结核患者中双阳占比71.1%,细菌性肺炎中双阳特异度为100%,该结果显示双阳的检测结果能够高度提示标本来源患者可能为ATB状态,并提高对细菌性肺炎的鉴别诊断,进一步排除有LTBI的细菌性肺炎,同时结合影像学、临床症状等进行综合诊断,对结核患者确诊、及时治疗及预防和控制结核病的蔓延具有重要意义;而对于已发现的LTBI者,尤其是高危人群,应积极进行预防性治疗,有效减少LTBI进展成为ATB的风险。双因子联合检测的双阳结果具有较好的提示ATB的效果,值得进一步研究。
本研究具有一定的局限性。肺结核患者纳入较少,且没有纳入其他肺炎患者,需要扩大样本量进一步验证其在各类肺炎患者中的鉴别诊断效果;未考虑患者间差异,如个体免疫情况和基础疾病的影响;未纳入LTBI人群,需进一步收集资料研究其对ATB和LTBI的区分效果,并采用更大规模的前瞻性研究来确定IFN-γ和IL-2联合检测作为TB感染诊断标志物的临床应用价值,更好的分析IFN-γ和IL-2联合检测区分ATB和LTBI效果。
综上所述,TB特异性细胞因子IFN-γ和IL-2联合检测鉴别诊断肺结核与细菌性肺炎具有良好的应用价值,可结合影像学、临床症状等综合诊断,对辅助临床结核病诊断和提示ATB具有较好的临床意义。
-
表 1 两组患者基本特征
Table 1 Basic characteristics of two groups of patients
特征 肺结核组(n=45) 肺炎组(n=46) 平均年龄(岁) 52.09±20.36 60.46±16.43 男性[例(%)] 27(60.0) 26(56.5) 抗酸染色阳性(例) 2 0 TB-DNA阳性(例) 35 0 mNGS TB基因阳性 7 0 表 2 两组患者IFN-γ、IL-2水平比较[M(P25,P75), pg/mL]
Table 2 Comparison of IFN-γ and IL-2 levels between two groups of patients (M [P25, P75], pg/mL)
指标 肺炎组(n=46) 肺结核组(n=45) Z P IFN-γ 1.33(0.16,5.32) 380.62(53.06,747.61) 7.036 < 0.001 IL-2 0.59(0,1.88) 81.28(7.81,244.47) 6.772 < 0.001 表 3 两组患者IFN-γ和IL-2联合检测结果[例(%)]
Table 3 Results of IFN-γ and IL-2 combined detection in two groups of patients (No. of cases [%])
双因子联合检测 肺结核组(n=45) 肺炎组(n=46) 阳性 39(86.7) 7(15.2) IFN-γ阳性且IL-2阳性 32(71.1) 0(0) IFN-γ阳性或IL-2阳性 7(15.6) 7(15.2) 阴性 6(13.3) 39(84.8) -
[1] World Health Organization. Global tuberculosis report 2023[EB/OL]. [2024-01-03]. http://www.who.int/teams/global-tuberculosis-programme/tb-reports/global-tuberculosis-report-2023. [2] Zhang L, Weng TP, Wang HY, et al. Patient pathway analysis of tuberculosis diagnostic delay: a multicentre retrospective cohort study in China[J]. Clin Microbiol Infect, 2021, 27(7): 1000-1006. doi: 10.1016/j.cmi.2020.12.031 [3] 廖艺璇, 方创森, 李燕明. 加强结核病非定点医疗机构能力建设提高结核病诊断水平[J]. 中国防痨杂志, 2023, 45(5): 437-441. Liao YX, Fang CS, Li YM. Strengthening the capability of non-tuberculosis-designated medical institutions to improve the diagnosis of tuberculosis[J]. Chinese Journal of Antituberculosis, 2023, 45(5): 437-441. [4] 中国医疗保健国际交流促进会临床微生物与感染分会, 中华医学会检验医学分会临床微生物学组, 中华医学会微生物学和免疫学分会临床微生物学组. 综合医院结核分枝杆菌感染实验室检查共识[J]. 中华检验医学杂志, 2022, 45(4): 343-353. Society of Clinical Microbiology and Infection of China International Exchange and Promotion Association for Medical and Healthcare, Clinical Microbiology Group of the Laboratory Medicine Society of the Chinese Medical Association, Clinical Microbiology Group of the Microbiology and Immunology Society of the Chinese Medical Association. Chinese expert consensus on the best practice of microbiological examination for Mycobacterium tuberculosis infection/tuberculosis in general hospital[J]. Chinese Journal of Laboratory Medicine, 2022, 45(4): 343-353. [5] 何燕超, 揭志军. 综合医院活动性肺结核的早期筛查策略[J]. 结核与肺部疾病杂志, 2022, 3(4): 334-337. He YC, Jie ZJ. Strategy of early screening for active pulmonary tuberculosis in general hospital[J]. Journal of Tuberculosis and Lung Disease, 2022, 3(4): 334-337. [6] Grossman RF, Hsueh PR, Gillespie SH, et al. Community-acquired pneumonia and tuberculosis: differential diagnosis and the use of fluoroquinolones[J]. Int J Infect Dis, 2014, 18: 14-21. doi: 10.1016/j.ijid.2013.09.013 [7] Kobashi Y, Abe M, Mouri K, et al. Usefulness of tuberculin skin test and three interferon-gamma release assays for the di-fferential diagnosis of pulmonary tuberculosis[J]. Intern Med, 2012, 51(10): 1199-1205. doi: 10.2169/internalmedicine.51.5703 [8] GBD 2019 Antimicrobial Resistance Collaborators. Global mortality associated with 33 bacterial pathogens in 2019: a syste-matic analysis for the global burden of disease study 2019[J]. Lancet, 2022, 400(10369): 2221-2248. doi: 10.1016/S0140-6736(22)02185-7 [9] Tan YJ, Tan YH, Li JL, et al. Combined IFN-γ and IL-2 release assay for detect active pulmonary tuberculosis: a prospective multicentre diagnostic study in China[J]. J Transl Med, 2021, 19(1): 289. doi: 10.1186/s12967-021-02970-8 [10] 刘玉梅, 王栋. WBC、CRP、SAA、PCT和ESR在肺结核与社区获得性肺炎鉴别诊断中的应用[J]. 标记免疫分析与临床, 2023, 30(9): 1527-1530, 1570. Liu YM, Wang D. The application of WBC, CRP, SAA, PCT and ESR in the differential diagnosis of pulmonary tuberculosis and community-acquired pneumonia[J]. Labeled Immuno-assays and Clinical Medicine, 2023, 30(9): 1527-1530, 1570. [11] 刘璐, 王希, 张维慧. 中性粒细胞与淋巴细胞比值在肺结核与细菌性社区获得性肺炎鉴别诊断中临床价值[J]. 中国老年学杂志, 2023, 43(3): 545-547. Liu L, Wang X, Zhang WH. The clinical value of the ratio of neutrophils to lymphocytes in the differential diagnosis of pulmonary tuberculosis and bacterial community-acquired pneumonia[J]. Chinese Journal of Gerontology, 2023, 43(3): 545-547. [12] 中华人民共和国国家卫生和计划生育委员会. 肺结核诊断: WS 288—2017[S]. 北京: 中国标准出版社, 2018. National Health and Family Planning Commission of the People's Republic of China. Diagnosis for pulmonary tuberculosis: WS 288-2017[S]. Beijing: Standards Press of China, 2018. [13] 中华医学会呼吸病学分会感染学组. 中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)[J]. 中华结核和呼吸杂志, 2018, 41(4): 255-280. Infectious Diseases Group, Chinese Society of Respiratory Medicine. Chinese guidelines for the diagnosis and treatment of hospital-acquired pneumonia and ventilator-associated pneumonia in adults (2018)[J]. Chinese Journal of Tuberculosis and Respiratory Diseases, 2018, 41(4): 255-280. [14] Cruciani M, Scarparo C, Malena M, et al. Meta-analysis of BACTEC MGIT 960 and BACTEC 460 TB, with or without solid media, for detection of Mycobacteria[J]. J Clin Micro-biol, 2004, 42(5): 2321-2325. doi: 10.1128/JCM.42.5.2321-2325.2004 [15] Casela M, Cerqueira SMA, Casela TDO, et al. Rapid molecular test for tuberculosis: impact of its routine use at a referral hospital[J]. J Bras Pneumol, 2018, 44(2): 112-117. doi: 10.1590/s1806-37562017000000201 [16] Yang C, Luo XJ, Fan L, et al. Performance of interferon-gamma release assays in the diagnosis of nontuberculous mycobacterial diseases-a retrospective survey from 2011 to 2019[J]. Front Cell Infect Microbiol, 2021, 10: 571230. doi: 10.3389/fcimb.2020.571230 [17] Sudbury EL, Clifford V, Messina NL, et al. Mycobacterium tuberculosis-specific cytokine biomarkers to differentiate active TB and LTBI: a systematic review[J]. J Infect, 2020, 81(6): 873-881. doi: 10.1016/j.jinf.2020.09.032 [18] 王丹丹, 赵真真. C反应蛋白、白细胞、血清淀粉样蛋白A和降钙素原在诊断细菌感染性肺炎疾病中的价值[J]. 现代实用医学, 2022, 34(5): 680-682. Wang DD, Zhao ZZ. Value of C-reactive protein, leukocyte, serum amyloid A and procalcitonin in the diagnosis of bacterial pneumonia[J]. Modern Practical Medicine, 2022, 34(5): 680-682.

 下载:
下载:
